Инвестиции
Стартапам
Инвесторам
Инвесторам
Аналитика
Инвестиции
Стартапам
Инвесторам
Аналитика
Спрос и кооперация
Спрос и кооперация
Развитие и продвижение бизнеса
Спрос
Кооперация
Спрос и кооперация
Развитие и продвижение бизнеса
Спрос
Кооперация
Гранты и кредиты
Гранты и кредиты
Инфраструктура
Инфраструктура
Современные пространства
для бизнеса
для бизнеса
Инфраструктура
Современные пространства
для бизнеса
для бизнеса
Патентование
Патентование
Обучение и карьера
Обучение и карьера
Проекты для мегаполиса
Проекты для мегаполиса
Технологические городские проекты
Проекты для мегаполиса
О Кластере
О Кластере
Лидеры цифровой трансформации
Лидеры цифровой трансформации
Академия инноваторов
Академия инноваторов
Новатор Москвы
Новатор Москвы
Обучение и карьера
Обучение и карьера
Образовательные программы и база знаний
Обучение
Обучение и карьера
Образовательные программы и база знаний


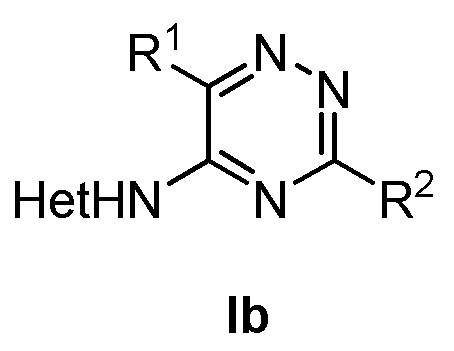
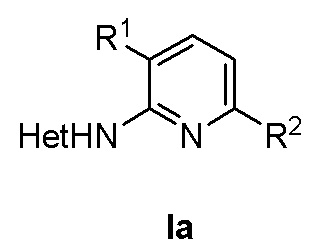 , где в формуле (Ia) R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; R2 представляет собой С1-3 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил, необязательно замещенный группой, выбранной из галогена, С1-6алкила и С1-6алкилокси; и Het представляет собой пиразол-4-ил, а также к способу получения соединений формулы (Ia) и к фармацевтической композиции, содержащей соединение формулы (Ia). Технический результат: получены новые соединения, которые могут быть использованы для лечения рака, такого как глиобластома человека, протоковая карцинома молочной железы человека, карцинома печени человека и эмбриональных почек человека. 4 н. и 2 з.п. ф-лы, 2 табл., 4 пр.
, где в формуле (Ia) R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; R2 представляет собой С1-3 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил, необязательно замещенный группой, выбранной из галогена, С1-6алкила и С1-6алкилокси; и Het представляет собой пиразол-4-ил, а также к способу получения соединений формулы (Ia) и к фармацевтической композиции, содержащей соединение формулы (Ia). Технический результат: получены новые соединения, которые могут быть использованы для лечения рака, такого как глиобластома человека, протоковая карцинома молочной железы человека, карцинома печени человека и эмбриональных почек человека. 4 н. и 2 з.п. ф-лы, 2 табл., 4 пр.
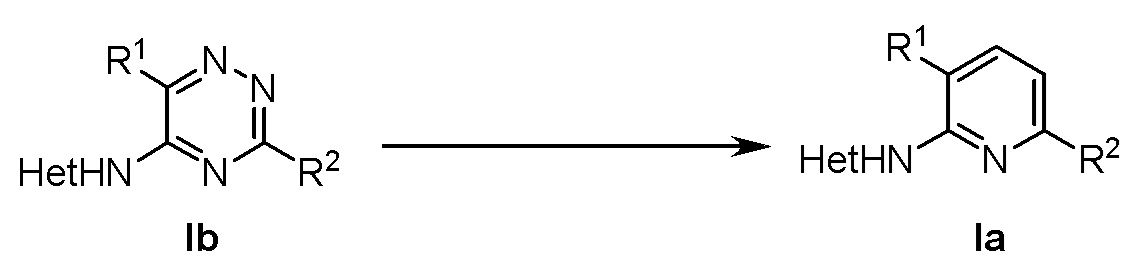 ,
, ,
,

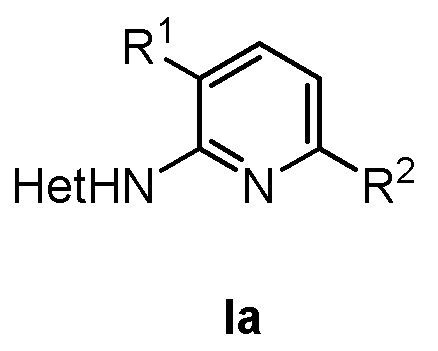
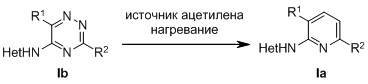 ,
,