Инвестиции
Стартапам
Инвесторам
Инвесторам
Аналитика
Инвестиции
Стартапам
Инвесторам
Аналитика
Спрос и кооперация
Спрос и кооперация
Развитие и продвижение бизнеса
Спрос
Кооперация
Спрос и кооперация
Развитие и продвижение бизнеса
Спрос
Кооперация
Гранты и кредиты
Гранты и кредиты
Инфраструктура
Инфраструктура
Современные пространства
для бизнеса
для бизнеса
Инфраструктура
Современные пространства
для бизнеса
для бизнеса
Патентование
Патентование
Обучение и карьера
Обучение и карьера
Проекты для мегаполиса
Проекты для мегаполиса
Технологические городские проекты
Проекты для мегаполиса
О Кластере
О Кластере
Лидеры цифровой трансформации
Лидеры цифровой трансформации
Академия инноваторов
Академия инноваторов
Новатор Москвы
Новатор Москвы
Обучение и карьера
Обучение и карьера
Образовательные программы и база знаний
Обучение
Обучение и карьера
Образовательные программы и база знаний


 Characteristic Bacteriolytic Activities of Staphylococcus hyicus. Journal of Clinical Microbiology, July 1989, p. 1682-1683.
Characteristic Bacteriolytic Activities of Staphylococcus hyicus. Journal of Clinical Microbiology, July 1989, p. 1682-1683.  C. Staphylococcus hyicus, the cause of exudative epidermit is of swine. Review. 1990. Berliner und Munchener Tierarztliche Wochenschrift 103(2): 60-63. Было высказано предположение, что антибактериальная активность в отношении микрококков может рассматриваться как видовой признак Staphylococcus hyicus. Однако дальнейшие исследования привели к выводу, что эта характеристика должна рассматриваться только как индивидуальное свойство отдельных штаммов, а не как видовой признак. В. Skalka. Antibacterial effects of Staphylococcus hyicus and Staphylococcus chromogenes. Acta Vet. BRNO, 62, 1993: 39-47.
C. Staphylococcus hyicus, the cause of exudative epidermit is of swine. Review. 1990. Berliner und Munchener Tierarztliche Wochenschrift 103(2): 60-63. Было высказано предположение, что антибактериальная активность в отношении микрококков может рассматриваться как видовой признак Staphylococcus hyicus. Однако дальнейшие исследования привели к выводу, что эта характеристика должна рассматриваться только как индивидуальное свойство отдельных штаммов, а не как видовой признак. В. Skalka. Antibacterial effects of Staphylococcus hyicus and Staphylococcus chromogenes. Acta Vet. BRNO, 62, 1993: 39-47.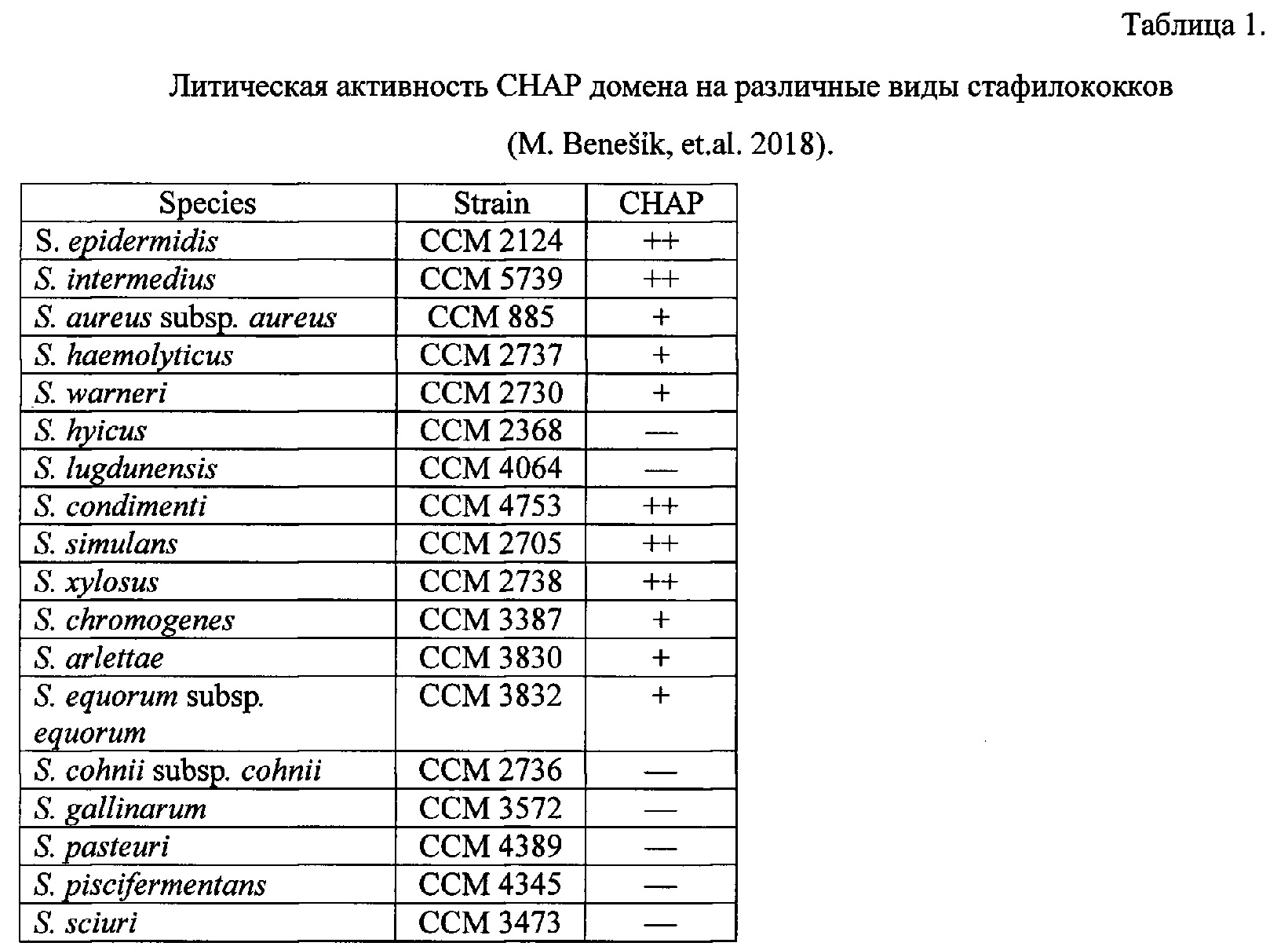
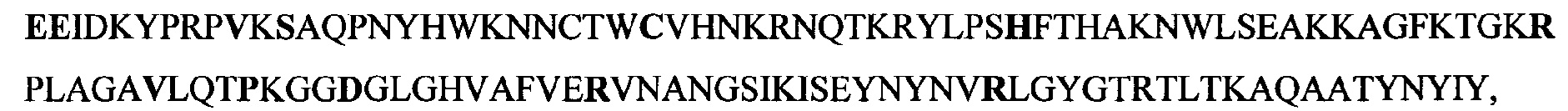 молекулярную массу 14000,75 Да, расчетное значение изоэлектрической точки pI=10.35, температурный оптимум ферментативной реакции в пределах 40°C, рН-оптимум фермента в пределах 7,7.
молекулярную массу 14000,75 Да, расчетное значение изоэлектрической точки pI=10.35, температурный оптимум ферментативной реакции в пределах 40°C, рН-оптимум фермента в пределах 7,7.
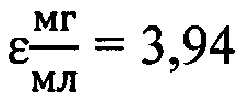 . Расчет проводили по формуле: (5700 nTyr + 1300 nTrp)/М, где М - молекулярная масса.
. Расчет проводили по формуле: (5700 nTyr + 1300 nTrp)/М, где М - молекулярная масса.
