Инвестиции
Стартапам
Инвесторам
Инвесторам
Аналитика
Инвестиции
Стартапам
Инвесторам
Аналитика
Спрос и кооперация
Спрос и кооперация
Развитие и продвижение бизнеса
Спрос
Кооперация
Спрос и кооперация
Развитие и продвижение бизнеса
Спрос
Кооперация
Гранты и кредиты
Гранты и кредиты
Инфраструктура
Инфраструктура
Современные пространства
для бизнеса
для бизнеса
Инфраструктура
Современные пространства
для бизнеса
для бизнеса
Патентование
Патентование
Обучение и карьера
Обучение и карьера
Проекты для мегаполиса
Проекты для мегаполиса
Технологические городские проекты
Проекты для мегаполиса
О Кластере
О Кластере
Лидеры цифровой трансформации
Лидеры цифровой трансформации
Академия инноваторов
Академия инноваторов
Новатор Москвы
Новатор Москвы
Обучение и карьера
Обучение и карьера
Образовательные программы и база знаний
Обучение
Обучение и карьера
Образовательные программы и база знаний


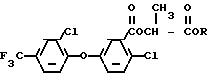
 O
O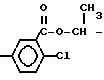
 (I) в которой
R
означает метил или этил. Эти соединения ранее не были описаны в литературе и могут применяться в сельском хозяйстве.
(I) в которой
R
означает метил или этил. Эти соединения ранее не были описаны в литературе и могут применяться в сельском хозяйстве.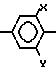 O
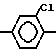
O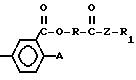 (IV) в которой A означает
атом галогена или циано-группу;
(IV) в которой A означает
атом галогена или циано-группу;
 -O-R
(II) в которой R означает метил или этил с, по меньшей мере, стехиометрическим количеством галоида, галоидангидрида, предпочтительно хлорангидрида
2-хлор-5-(2-хлор-4-трифторметилфенокси)бензоила,
желательно в присутствии кислотосвязывающего средства, или
-O-R
(II) в которой R означает метил или этил с, по меньшей мере, стехиометрическим количеством галоида, галоидангидрида, предпочтительно хлорангидрида
2-хлор-5-(2-хлор-4-трифторметилфенокси)бензоила,
желательно в присутствии кислотосвязывающего средства, или
 -O-R (III) в которой R означает метил или этил, а
Hal-атом хлора или брома, с 2-хлор-5-(2-хлор-4-трифторметилфенокси)бензойной кислотой, предпочтительно в присутствии аза-соединения, например,
1,5-диазабицикло[5.4.0]ундек-5-ена (DBU).
-O-R (III) в которой R означает метил или этил, а
Hal-атом хлора или брома, с 2-хлор-5-(2-хлор-4-трифторметилфенокси)бензойной кислотой, предпочтительно в присутствии аза-соединения, например,
1,5-диазабицикло[5.4.0]ундек-5-ена (DBU).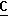 OOCH), 164,0 (c,
OOCH), 164,0 (c, 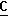 OOCH3), 52,5 (c, O
OOCH3), 52,5 (c, O H3) 16,9 (c, CH3), 70,0 м.д. (с,
СН).
H3) 16,9 (c, CH3), 70,0 м.д. (с,
СН).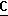 OOCH), 164,0 (c,
OOCH), 164,0 (c, 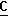 OOCH3), 52,5 (c, O
OOCH3), 52,5 (c, O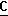 H3), 16,9 (c, CH3), 70,0 м.д. (с, СН).
H3), 16,9 (c, CH3), 70,0 м.д. (с, СН). OOCH), 164,0 (c,
OOCH), 164,0 (c, 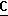 OOCH2CH3), 61,6 (c,
OCH2), 14,1
(c, CH
OOCH2CH3), 61,6 (c,
OCH2), 14,1
(c, CH H3), 16,9 (c, CH3), 70,1 м.д. (С, СН).
H3), 16,9 (c, CH3), 70,1 м.д. (С, СН).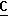 OOCH), 164,0 (c,
OOCH), 164,0 (c,  OOCH2CH3), 61,6 (c, OCH2), 14,1 (c, CH
OOCH2CH3), 61,6 (c, OCH2), 14,1 (c, CH H3), 16,9 (c, CH3), 70,1 м.д. (с, СН).
H3), 16,9 (c, CH3), 70,1 м.д. (с, СН).
