[1] Область изобретения
Данное изобретение относится к способу получения синтетического газа взаимодействием гидрокарбильного соединения с
источником кислорода при повышенной температуре. В частности, данное изобретение относится к получению синтетического газа с использованием новых никельсодержащих катализаторов, необычайно стойких к
дезактивации. Кроме того, данное изобретение относится к исходному веществу для получения нового никельсодержащего катализатора и каталитическим композициям, используемым для получения синтетического
газа, причем катализаторы устойчивы к образованию кокса при катализе реакции гидрокарбильного соединения с кислородсодержащим газом при повышенных температурах с образованием синтетического газа.
[2] Уровень техники
Синтетический газ, смесь окиси углерода (СО) и молекулярного водорода (H2), является ценным промышленным сырьем для получения многих химических
соединений. Например, синтетический газ можно использовать для получения метанола или уксусной кислоты. Синтетический газ может также быть использован для получения высокомолекулярных спиртов или
альдегидов, а также высокомолекулярных углеводородов.
[3] По всей видимости, наиболее распространенным источником синтетического газа является пар, образующийся при крекинге угля или
углеводородов, особенно природного газа. В процессе крекинга смесь воды и углеводорода контактирует при высокой температуре, например, при 850-900oС и обычно в присутствии катализатора с
образованием смеси водорода и моноокиси углерода. При использовании в качестве углеводорода метана теоретическое стехиометрическое уравнение реакции крекинга следующее:
СH4 + Н2O 3Н2 + СО
для известных способов крекинга, при этом большое количество пара необходимо для компенсации образования кокса и отношение образующегося Н2 к СО обычно
больше, чем 3 1 и может доходить до 5 1.
[4] Реакция парового крекинга является сильно эндотермической и, как указано выше, она приводит к сравнительно высокому мольному отношению водорода
к моноокиси углерода при осуществлении известных способов. По некоторым способам избыток водорода не является необходимым и должен быть отделен от СО. Например, производство метанола или уксусной
кислоты из синтетического газа требует мольного отношения водорода к моноокиси углерода меньшего, чем 3 1. Существуют другие способы получения синтетического газа, имеющие преимущества по сравнению с
паровым крекингом. Например, получение синтетического газа частичным окислением метана является экзотермической реакцией, при этом получается синтетический газ с низким отношением водорода к моноокиси
углерода по следующему уравнению:
СH4 + 1/2O2 2Н2 + СО.
[5] Синтетический газ можно также получать взаимодействием гидрокарбильного соединения,
например, метана, с двуокисью углерода. Эта реакция протекает согласно уравнению:
СH4 + СО2 2Н2 + 2СО.
[6] Эта реакция, как и паровой крекинг,
является эндотермической, однако, она приводит к низкому отношению водорода к моноокиси углерода (1 1) и очень пригодна для случаев, когда имеется неограниченный запас углекислого газа, например, на
нефтеперегонных заводах или вблизи источника природного СО2. Кроме того, реакция крекинга с использованием углекислого газа может также использоваться в сочетании с паровым крекингом для
регулирования отношения водорода к моноокиси углерода.
[7] Во всех вышеописанных способах получения синтетического газа предпочтительно проводить реакцию гидрокарбильного соединения с
источником кислорода в присутствии катализатора. Например, катализаторы для парового крекинга метана и других углеводородов обычно основаны на никеле в качестве активного компонента катализатора.
(Vernon et al Catalysis Letters, Vol.6, p.181-186, 1990) раскрывает, что метан можно превратить в синтетический газ над такими катализаторами, как палладий, платина или рутений на окиси алюминия,
никель на окиси алюминия и некоторые окислы переходных металлов, включая Pr2 Ru2O7 или СU2. Jr2O7. В то время как Vernon et al
указывают, что никель на окиси алюминия эффективен в процессе конверсии метана в синтетический газ с использованием молекулярного кислорода, мы определили, что такой катализатор, также как
промышленные никельсодержащие катализаторы крекинга и парового крекинга, приводят к образованию кокса и дезактивируются сравнительно быстро. Хотя другие катализаторы, описанные Vernon et аl например,
рутений на окиси алюминия, могут быть использованы для крекинга гидрокарбильного соединения, например, метана, в присутствии молекулярного кислорода, такие переходные металлы являются дорогими и мы
определили, что катализаторы на основе рутения проявляют более низкую селективность и обеспечивают более низкую конверсию в синтетический газ в сравнении с катализаторами по данному изобретению.
Ashcroft et.al Nature, Vol.352, p.225, 1991, описывают крекинг метана с двуокисью углерода с образованием синтетического газа при использовании таких катализаторов, как палладий, рутений или иридий на
окиси алюминия, а также никель на окиси алюминия.
[8] В патенте США 3791993 описано получение катализаторов, содержащих никель, для крекинга газообразных или испаряющихся жидких
углеводородов с использованием пара, окиси углерода, кислорода и/или воздуха.
[9] Эти катализаторы получают соосаждением соли никеля, соли магния и алюмината с образованием отстоя,
промывкой отстоя до тех пор, пока он практически не будет содержать натрий или калий, сушкой и затем дегидратацией при 300-750oС. Конечный катализатор образуется после стадии прокаливания
при 850-1100oС. Примеры; приведенные в патенте США 3791993, показывают, что композиции с мольным отношением никеля, магния и алюминия 1 1 2 или 2 7 1 соответственно, пригодны для
превращения нафты в газообразные продукты, обогащенные водородом, в процессе парового крекинга.
[10] Вследствие большого промышленного интереса к получению синтетического газа путем
крекинга легко доступного углеводородного сырья, например, природного газа, и благодаря преимуществам проведения крекинга в присутствии катализатора, который остается активным в течение
продолжительного промежутка времени, существует постоянная необходимость в новых, менее дорогостоящих, устойчивых к образованию кокса, более активных и селективных катализаторах для производства
синтетического газа. Настоящее изобретение предусматривает такие катализаторы, а также способ получения синтетического газа с их использованием.
[11] Катализаторы, используемые по способу в
соответствии с данным изобретением, могут быть получены из никельсодержащего исходного соединения ("прекурсора"), имеющего структуру, называемую " гидроталькитоподобной". Гидроталькитоподобные
соединения представляют собой анионные глины, как природные, так и синтетические, которые имеют слоистую или листоподобную структуру. Например, гидроталькит, минерал природного происхождения, имеет
химический состав Mg6Al2(OH)16CO3o4H2O и состоит из молекулярных "листов", причем каждый лист включает смесь гидроокисей
магния и алюминия. Листы разделены ионами карбоната, которые уравновешивают позитивный заряд листов. В этих "листах" ионы магния и алюминия в гидроокиси образуют 6-валентное координационное соединение
и образующиеся октаэдры соприкасаются краями с образованием бесконечных листов. Молекулы воды, как и карбонатные ионы, расположены хаотически в пространстве между этими листами. Хотя чистый
гидроталькит содержит только катионы магния и алюминия, известны различные"гидроталькитоподобные" композиции как природного, так и синтетического происхождения. Эти соединения характеризуются общей
формулой
[M2+(1-x)M3+
x(OH)2]x+(An-x/n)•mH2O,
где x обычно число в интервале между 0,1 и 0,50, М2+ ион двухвалентного металла, например, Mg2+ и М3+ ион трехвалентного металла, например, Аl3+.
Анион Аn- может быть одним из группы анионов, например, ионом карбоната.
[12] Гидроталькитоподобные соединения, содержащие в качестве аниона борат, описаны Bhattachar et al.
Inorganic Chemistry, Vol.31.p.3869, 1992. Dresdzon Inorgania Chemistry, vol. 27, 4628, 1988, раскрыл метод синтеза гидроталькитов на основе изополиметаллата.
[13] Как указано выше,
гидроталькитоподобные соединения характеризуются структурными характеристиками, которые обычно определяют методом порошковой дифракции х-лучей (XRD). Такие соединения обычно имеют d (0 01) величину,
равную, по меньшей мере, 7,8  . В зависимости от размера аниона молекулы могут характеризоваться величинами d
(001), равными до 15
. В зависимости от размера аниона молекулы могут характеризоваться величинами d
(001), равными до 15 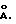 . Величина d (001) является показателем внутрислойного пространства в гидроталькитоподобных
материалах.
. Величина d (001) является показателем внутрислойного пространства в гидроталькитоподобных
материалах.
[14] Соединения, подобные гидроталькиту, использовали в качестве катализаторов в различных областях, например, для альдольной конденсации, полимеризации окисей алкенов,
гидрирования, дегидрирования и т.д. (F.Cavani et а1.Catalysis Today, Vоl. 11, р.p.173301, 1991) Cavani et al. описывают, что соосажденные катализаторы на основе Ni. Al удовлетворяют требованиям
парового крекинга в производстве метана и что соосажденные катализаторы, прокаленные при 723К (450oС) и восстановленные при 723К (450oС), были активны при 673-923К (450oС-650oС) в процессе парового крекинга нафты при получении метана.
[15] В патенте США 3865753 описано использование катализатора, полученного прокаливанием [Ni5
MgAl(OH)16] CO3•4H2O при 350-550oС с последующим восстановлением водородом. Такой катализатор использовали для парового крекинга углеводородов,
содержащих 2-30 атомов углерода, при 350-450oС, с образованием Метана Ross et al.(J.of Catalysis, Vol.52, p.p.280-290,1978). Изучали реакцию метана с водой над катализаторам, полученным из
Ni6Al2(OH)16CO3•4Н2O при 873-973К (600-700oС). Kruissink et al.(J.Chenical Society. Fareday Jrans I. Vol.77, 649 663, 1981),
описывает термическую обработку никельсодержащий композиции с характеристиками дифракционных решеток (х-лучи) гидроталькитоподобных соединений, а Hernander et al. b Thermochemica Acta.Vol.81, 311-318,
1984) исследовали термическое разложение подобных соединений формулы [Ni(1-x)Alx(OH)2]x+nхx/n• m H2O, где 0,25 х 0,33 и х
анион карбоната и сульфата. Используя дифракционный анализ при помощи х-лучей, эти исследователи определили, что окись никеля является продуктом разложения при температурах выше 600oС, в то
время как соответствующая шпинель NiAl2O4 образуется при температурах выше 1000oС. В Патенте Великобритании 1342020 описаны катализаторы состава Ni6Al2CO3(OH)16•4Н2O Ni3Mg3Al2CO3(ОН)16•4Н2O, используемые как катализаторы
гидрирования, деалкилирования и крекинга. Clause et al. J.of Catalysis, V.133,p.231-246, 1992. Описывают получение и исследование смешанных окислов никеля-алюминия, полученных термическим разложением
осадков типа гидроталькита. В этой статье также сообщается, что смешанные окислы никеля-алюминия, полученные термическим разложением соосажденных соединений типа гидроталькита, были использованы в
процессах парового крекинга и конверсии окиси и двуокиси углерода водородом в метан.
[16] Сущность изобретения
Согласно одному аспекту данное изобретение относится к способу
получения синтетического газа, заключающемуся в подаче газообразного или испаряющегося гидрокарбильного соединения и кислородсодержащего газа в реакционную зону, содержащую катализатор, полученной
термической обработкой никельсодержащего гидроталькитоподобного соединения, и взаимодействии гидрокарбильного соединения и кислородсодержащего газа в присутствии катализатора при температуре и
давлении, достаточных для образования синтетического газа. Кислородсодержащий газ представляет собой молекулярный кислород, двуокись углерода, воду или любую смесь двух или более этих соединений.
Согласно другому аспекту изобретение относится к катализаторам крекинга, полученным термообработкой до температур, по меньшей мере, около 700oС предшественника (прекурсора) катализатора,
представляющего собой композицию, содержащую, по меньшей мере, одно гидроталькитоподобное соединение формулы:
[M2+
(1-x)M3+x(OH)2]x+(An-x/n)•mH2O,
где М2+ ион двухвалентного металла, никеля2+ или, предпочтительно,
смеси Ni2+ и Mg2+ с одним или более металлами, тоже двухвалентными и выбранными из группы: Cu2+, Co2+, Zn2+, Fe2+ или Mn2+
М3+ ион трехвалентного металла, выбранный из группы:
Аl3+, Ga3+, Ni3+, Co3+, Fe3+, Cr3+, V3+,
Ti3+, La3+ или Zn3+, предпочтительно M3+ представляет собой А3+, необязательно с одним или более металлом, выбранным из группы: Ga3+,
Ni3+, Co3+, Fe3+, Mn3+, Cr3+, V3+, Ti3+, La3+ или Jn3+,
x число от 0,1 до 0,50, где величины
х и (1-х) получаются при сочетании всех ионов метaлла, имеющих 3+ валентность и 2+ - валентность соответственно; An- анион с отрицательным зарядом n и "n" - может быть
от 1 до 10, а m 0 или положительное число. Может быть использована смесь анионов.
[17] Согласно другому аспекту изобретение относится к предшественнику катализатора формулы
[M2+(1-x)M3+x(OH)2]x+(An-x/n)•mH2O,
где М2+ ион двухвалентного металла, являющийся, по меньшей мере, смесью Ni2+ и Mg2+, необязательно в сочетании с одним или более металлами, выбранными из группы: Cu2+,
Cо2+, Z2+, Fe2+ или Mn2+,
М3+ ион трехвалентного металла, являющийся, по меньшей мере Al3+, необязательно в смеси с одним
или более другими ионами трехвалентного металла, выбранного из группы: Ga3+, Ni3+, Co3+, Fe3+, Mn3+, Cr3+, V3+, Ti3+, La3+ или Jn3+,
x число больше чем величина от 0,25 до 0,50; An- анион с отрицательным зарядом n, где "n" 1 10 и m 0 или положительное число.
[18] Согласно еще одному аспекту изобретение относится к никельсодержащей каталитической композиции, содержащей смесь M2+O, шпинели М2+ Al2O4 и
гибридную фазу, содержащую М2+О и шпинельный компонент М2+ Al2O4 в одном и том же кристаллите, причем эти компоненты соединены друг с другом в кристаллите
через эпитаксиальную межфазную поверхность. Катализаторы, содержащие такую гибридную фазу, являются высокоактивными при осуществлении крекинга по данному изобретению.
[19] В этой гибридной
фазе М2+ Ni2+ и может быть смесью и другого иона металла, предпочтительно, двухвалентного.
[20] Краткое описание рисунков
На рис.1 представлена полученная с
помощью электронного микроскопа с высокой степенью разрешения микрофотография катализатора по изобретению после термической активации катализатора в условиях, не подходящих для крекинга.
[21] На рис.2 представлена полученная с помощью электронного микроскопа с высокой степенью разрешения микрофотография катализатора по изобретению после использования его в условиях крекинга.
[22] На рис.3 схематическое изображение структуры никельсодержащих катализаторов по изобретению в условиях крекинга.
[23] Подробное описание изобретения
Катализаторы,
используемые по данному изобретению для получения синтетического газа, получают термической обработкой предшественника катализатора, представляющего собой композицию, содержащую одно и более
"гидроталькитоподобных" соединений формулы
[M2+(1-x)M3+x(OH)2]x+(An-x/n)•mH2O,
где М2+ Ni2+ или смесь Ni2+ и, по меньшей мере, одного другого иона металла, предпочтительно, двухвалентного и,
особенно предпочтительно, выбранного из группы Ca2+, Cd2+, Cо2+, Cu2+, Fe2+, Mg2+, Mn2+, Pd2+, Pt2+,
Sz2+, Ti2+, V2+, Zn2+ и Zr2+.
[24] Атомное отношение Ni2+ к другому иону металла или ионам, имеющим 2+ заряд,
находится в интервале от 100:1 до 0,05:1, предпочтительно, от 5:1 до 0,1:1.
[25] М3+ представляет собой, по меньшей мере, один ион трехвалентного металла и, предпочтительно,
выбирается из группы:
Аl3+, B3+, Cr3+, Fe3+, Ga3+, Zn3+, La3+, Ni3+, Co3+, Mn3+,
Rh3+, Ti3+, Tl3+, V3+ и ионы трехвалентных лантаноидов. Предпочтительно, М3+ является Аl3+. Когда используют смесь Аl3+ и
по меньшей мере, одного другого иона трехвалентного металла, атомное отношение Аl3+ к другому Me3+ или другим ионам находится в интервале от 100:1 до 0,05:1.
[26]
Анион А в формуле (I) может быть любым, ответственным за "гидроталькитоподобную" структуру и может быть, например, анионом карбоната, нитрата, галоидида (например, Сl-, Br-),
хлората, сульфата, гидроокиси, оксида, карбоксилатов и поликарбоксилатов, особенно тех, которые содержат от 1 до 20 атомов углерода, включая, например, ацетат, бензоат, фталаты и т.п. фосфаты,
борсодержащие анионы, металаты металлов группы У1б Периодической системы элементов. Примерами боратов и металатов являются В(ОН)4, [B3O3(OH)4]-,
[B3O3(OH)5]2-, [B4O5(OH)4]2-, V2O4-7, HV2O3-7 , V4Ox-12, V3O3-9
и V10O6-28 Примерами фосфатов являются PO3-4, HPO2-4 и H2PO-4. Другими ионами могут быть 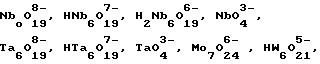 , анионы Кеггина, например, PW11O7-39 и SiW11O7-38, которые стабильны при рН 6. Величина х 0,1-0,5, предпочтительно 0,25 -0,45. Величина "n" 1-10. Количество воды в
предшественнике катализатора меняется. Оно таково, что величина "m" в формуле равна от О до 2.
, анионы Кеггина, например, PW11O7-39 и SiW11O7-38, которые стабильны при рН 6. Величина х 0,1-0,5, предпочтительно 0,25 -0,45. Величина "n" 1-10. Количество воды в
предшественнике катализатора меняется. Оно таково, что величина "m" в формуле равна от О до 2.
[27] Например, гидроталькитоподобное соединение формулы [Ni0,625Cu0,125
Al0,25(OH)2]0,25 (CO3)0,125• 0,5 H2O является подходящим предшественником для получения активного катализатора крекинга метана
в соответствии со способом по данному изобретению. В этой формуле Ni Cu имеют валентность равную 2+, Аl имеет валентность 3+, x= 0,25 и m= 0,5. Однако, более удобно представить
эту формулу с целыми числами, поэтому, если дробные числа умножить на 8, та же самая формула может быть выражена: [Ni5CuAl2(OH)16CO3]•4H2
O.
[28] Формулы гидроталькитоподобных соединений в данном описании представлены с целыми числами. Другим примером подходящего предшественника катализатора является [NiZnMg2Al2(OH)12] Mо2О7•4H2O В этом соединении х 0,333, n 2, m 0,666 и дробные числа были умножены на 6, чтобы получить целые числа. Еще одним примером
служит соединение формулы [Ni4Zn2Cu2Mg4Al4(OH)32]V4-O12•8H2O.
[29] В этой формуле х
0,25, n 4, m 0,5 и дробление числа были умножены на 16.
[30] Предпочтительными предшественниками соединениями для получения катализаторов по данному изобретению являются соединения
вышеприведенной формулы (I), где М2+ Ni2+, смесь Ni2+ и Mg2+, смесь Ni2+ и Cu2+ или смесь Ni2+, Cu2+ и Mg2+ и где М3+ Al3+. В этих соединениях, где используется смесь никеля и магния и/или меди, мольное отношение Ni2+ к Mg2+ и/или Cu2+
находится в интервале от 1:100 до100:1. Конкретными примерами таких предшественников катализатора являются [Ni8Al2(OH)20]CO3•yH2O; [Ni6Al2(OH)16]CO3•yH2O;
[Ni5MgAl2(OH)16] СО3•yH2O; [Ni4Mg2Al2(OH)16] CO3•yН2O; [Ni3Мg3Аl2(ОН)16] СО3•YH2O; [Ni2
Mg4Al2(OH)16]СО3•yH2O; [NiMg5Al2(OH)16]CO3•YH2O;
[Ni4
Al2(OH)12] CO3•YH2O; [Ni3MgAl2(OH)12] CO3•YH2O; [Ni2Mg2Al2(OH)12] CO3•YH2O; [NiMg3Al2(OH)12]CO3•YH2O; [Ni14Al6(OH)40
](CO3)3•YH2O;
[Ni12Mg2Al6(OH)40](CO3)3•- YH2O; [Ni1
Mg13Al6(OH)40](CO3)3•- yH2O; [Ni3Al2(OH)10]CO3•yH2O; [Ni2MgAl12(OH)10]CO3•yH2O; [Ni1Mg2Al2(OH)10] CO3•YH2O; [Ni2
Al2(OH)8]CO3•YH2O; [NiMgAl2(OH)8]CO3•YH2O;
[Ni2MgCuAl2(OH)12]CO3•YH2O; [Ni2Cu2Al2(OH)12]CO3•YH2O;
и другие и где Y в этих формула равен
0-20.
[31] Наиболее предпочтительной группой предшественников катализатора, используемых по способу в соответствии с данным изобретением, являются соединения формулы (I), где М2+
смесь Ni2+ и Mg2+ но могут также содержать один или более других ионов двухвалентного металла, предпочтительно, выбранных из группы: Cu2+, Со2+, Zn2+, Fe2+ или Mn2+, М3+ ион трехвалентного металла, являющийся Аl3+, или смесью с одним или более ионами трехвалентного металла, предпочтительно,
выбранного из группы: Ga3+, Ni3+, Co3+, Fe3+, Mn3+, Cr3+, V3+, Ti3+, La3+ или Jn3+,
x число, более 0,25, предпочтительно превышающее 0,28-0,50, наиболее предпочтительно, 0,45. Аn- анион, например, из числа вышеуказанных "m" 0 или положительное число. Катализатор,
полученный из этих предшественников, демонстрирует высокую активность и устойчивость к образованию кокса в процессе крекинга.
[32] Другой особенно предпочтительной группой предшественников
катализатора являются гидроталькитоподобные соединения формулы (I), где М2+ - предпочтительно, смесь Ni+2 и Co2+ и где М3+ Аl3+, х 0,1-0,5,
предпочтительно, 0,25-0,45, А анион, предпочтительно, вышеуказанный, с отрицательным зарядом, "n" и "m" равен О или положительному числу, предпочтительно, 0-2.
[33] Предшественники
катализатора активируют путем термической обработки, т. е. они являются термоактивированными. Термообработку обычно осуществляют, нагревая соединение до температуры выше 700oС,
предпочтительно, по меньшей мере, до720oС, более предпочтительно, до 750oС, еще лучше до800oС, в течение времени, достаточного для превращения предшественника в
активный катализатор для крекинга гидрокарбильных соединений. Эта термообработка может быть проведена до использования предшественника катализатора для крекинга или она может быть осуществлена в
реакторе крекинга, предпочтительно, в условиях крекинга, и, более предпочтительно, в условиях, применяемых для получения синтетического газа взаимодействием гидрокарбильного соединения с молекулярным
кислородом или двуокисью углерода, как описано ниже. Например, температуры, используемые в процессе крекинга обычно достаточно высоки для активации предшественников катализатора. Во время
термообработки с образованием активного катализатора гидроталькитоподобные соединения вначале теряют воду, располагающуюся между слоями гидроокисей. Обычно это происходит при температурах в интервале
200-250oС. Эта реакция является, однако, обратимой, т.к. дегидратированные гидроталькитоподобные композиции могут опять присоединять воду и восстанавливать первоначальную структуру типа
гидротальнита. При нагревании до более высоких температур, например выше 450oС, предшественник катализатора претерпевает другие изменения, когда происходит потеря аниона, если он летуч, или,
например, анион теряет воду, если он не является летучим. Однако это превращение не разрушает необратимо сложную структуру композиции, т.к. слоистая структура может быть восстановлена замещением
аниона или гидратированием аниона при нагревании до еще более
высоких температур, например свыше 700oС, происходит необратимое разрушение слоистой структуры и эти термоактивированные
композиции являются активными катализаторами крекинга гидрокарбильных соединений в соответствии со способом по данному изобретению.
[34] Мы определили, что когда никельсодержащие
предшественники катализатора нагревают или термоактивируют при температурах выше 700oС, предпочтительно, до 800-1050oС, образуется новая гибридная фаза. Исследование
термообработанных [Ni4Al2(OH)12]CO3•4H2O и [Ni2Mg2Al2(OH)12]CO3•4Н2O методом электронной микроскопии с высокой степенью разрушения показали, что термообработанные образца содержат новую гибридную фазу, содержащую смесь NiO или NiO/MgO и шпинели NiAl2
O4 или шпинели NiAl2O4/MgAl2O4 или шпинели Ni/MgAl2O4 в одном и том же кристаллите, причем NiO или NiO/MgO и шпинельные
фазы соединяются в кристаллите эпитаксиальной межфазной поверхностью. Под эпитаксиальной поверхностью мы подразумеваем поверхность в едином кристаллите, где, между двумя различными кристаллическими
областями в одном и том же кристаллите, сосуществуют две кристаллические области, которые образуют хорошо выраженную межфазную поверхность. Катализаторы, содержащие эту гидридную фазу, высокоактивны в
процессе крекинга по изобретению. Таким образом, данное изобретение относится к композиции катализатора, содержащего гибридный каталитический компонент, состоящий из компонента М2+О и
шпинельного компонента M2+Al2O4 в одном и том же кристаллите, причем M2+Al2O4 в кристаллите и M2+Al2O4
в кристаллите соединяются через эпитаксиальную межфазную поверхность. М2+ в этом гибридном компоненте является Ni2+ и может быть смесью Ni2+ и другого иона
предпочтительно двухвалентного металла, предпочтительно выбранного из группы: Mg2+, Cu2+, Cо2+, Zn2+, Fe2+ или Mn2+. Эти кристаллиты,
содержащие гибридную фазу, обычно имеют размер 5 400 нм, предпочтительно 5-100 нм. Такая каталитическая композиция, содержащая гибридную фазу, может быть подучена нагреванием одного или нескольких
никельсодержащих предшественников типа гидроталькита до температуры 800-1050oС и, предпочтительно, нагреванием никельсодержащего предшественника формулы
[M2+(1-x)M3+x(OH)2]x+(An-x/n)•mH2O,,
где М2+ Ni2+,
или, предпочтительно, смесь Ni2+ и Mg2+, и М3+ Аl3+. Предпочтительными каталитическими композициями по изобретению, используемыми для получения
синтетического газа, являются композиции, полученные термообработкой одного или более соединений формулы:
[M2+(1-x)M3+x(OH)2]x+(An-x/n)•mH2O,,
где М2+ ион двухвалентного металла, являющийся Ni2+ или,
предпочтительно, смесью Ni2+ и Mg2+, возможно, в сочетании с ионами одного или нескольких ионов двухвалентного металла, предпочтительно, выбранных из группы: Cu2+,
Cо2+, Zn2+, Fe2+ или Mn2+ более предпочтительно, выбранных из группы; Cu2+ или Zn2+, M3+ ион трехвалентного металла,
выбранного, по меньшей мере, из группы: Аl3+, Ga3+, Ni3+, Co3+, Fe3+, Mn3+, Cr3+, V3+, Ti3+, La3+ или Zn3+, предпочтительно М3+ Аl3+, необязательно в смеси с ионом, выбранным из группы: Ga3+, Ni3+, Co3+, Fe3+,
Mn3+, Cr3+, V3+, Ti3+, La3+ или In3+ и, наиболее предпочтительно, M3+=Al3+; х 0,1-0,5, предпочтительно 0,25-0,45,
причем величина "х" и (1-х) получены при сочетании всех ионов трехвалентных и двухвалентных металлов соответственно и анион Аn-. Это анион с отрицательным зарядом "n ", отвечающий за
структуру гидроталькита, выбранный из ионов карбоната, нитрата, галогидида, сульфата, хлората, гидроокиси, окиси, карбоксилата, фосфатов, борсодержащих анионов, металатов У-б и У1-б групп и т.п. и,
предпочтительно, А карбонат, а величина " m" равна 0 или положительному числу, предпочтительно, 0-2. В частности, предпочтительными каталитическими композициями являются вышеописанные
"гидроталькитоподобные"соединения, обработанные такими реагентами и в таких условиях реакции, которые используются для получения синтетического газа взаимодействием гидрокарбильного соединения с
молекулярным кислородом или с двуокисью углерода.
[35] Предпочтительной группой анионов в соединениях, используемых для приготовления катализаторов, является группа, состоящая из молибдатов
и полиоксомолибдатов, например, Mo7O6-24, MoO2-4, MoO-4 и т.п.
Предпочитают именно эти молибдаты и полиоксимолибдаты потому, что они придают каталитической композиции способность уменьшать образование кокса.
[36] Предшественники катализаторов по
данному изобретению могут быть получены по способам известным из уровня техники.
[37] Однако один способ получения этих гидроталькитоподобных соединений заключается в соединении в растворе,
предпочтительно водном, соединения двухвалeнтного никеля или его смеси с одним или несколькими другими ионами двухвалентных металлов, указанных выше, с одним или несколькими ионами трехвалентных
металлов, описанных выше. Подходящими соединениями металлов являются нитраты, хлориды, сульфаты и т.д. Раствор, содержащий ионы 2-х и 3-х валентных металлов, соединяют с раствором желаемого аниона А
или предшественника аниона. Например "А" может быть CO2-3, O2-4, Cl- и т.д. Предшественником аниона является соединение, из которого получается желаемый анион, при условиях
реакции используемых для получения гидроталькитоподобных соединений. Например, NaVO3 является предшественником аниона V2O
4-7.. Зависимость некоторых металитов переходных элементов от величины pН описана в Kepert D.L. "Jae Early Transition Metals" Academic Press, London
(1972).
[38] Кроме того, рН реакционной смеси для образования осадка гидротальнитового типа должен быть таким, чтобы все ионы М2+ и М3+, выбранные для конкретной
композиции, вошли в состав соосажденного продукта. В таблице, приведенной ниже, указаны приблизительные интервалы значений рН, при которых образуются соединения подобные гидроталькиту.
[39]
Например, для того, чтобы получить никель-алюминий содержащее соединение с карбонатным анионом, соли никеля и алюминия соединяются в воде и затем добавляются к раствору, содержащему карбонат. Из
вышеприведенной таблицы видно, что приблизительный интервал рН для получения гидроталькитоподобных соединений равен 6-12. Точно также, если хотят получить медьникельалюминийсодержащее соединение, рН
должен быть от 6 до 12. Если нужный анион Аn- нестабилен в этом интервале рН соединение типа гидроталькита не образуется. Если значение рН нужно отрегулировать, можно использовать основание,
например, гидроокись аммония, гидроокись щелочного металла или гидроокись тетраалкиламмония. Если для регулирования рН требуется кислота, можно иcпользовать минеральную кислоту, например, азотную или
соляную. После того, как нужное значение рН установлено, обычно раствор следует нагреть в течение некоторого времени, предпочтительно, при 40-90oС для ускорения образования осадка, который
можно выделить фильтрацией.
[40] Мольное отношение ионов двухвалентного металла к ионам трехвалентного металла, предпочтительно, составляет от 9:1 до1 1. Мольное отношение аниона к общему
количеству ионов 2-х и 3-х валентных металлов зависит от заряда аниона. Для каждого иона трехвалентного металла требуется соответствующий отрицательный заряд анионного слоя в "гидроталькитоподобном"
соединении. Обычно используют мольный избыток аниона в процессе получения соединений типа гидроталькита для обеспечения полноты реакции.
[41] Соединения 2-х и 3-х валентного металлов лучше
смешивать вместе и добавлять при перемешивании медленно к нагретому раствору аниона. Как указано выше, полученный раствор должен иметь соответствующее значение pH. Более медленное добавление и
применение более высокой температуры (может быть использован автоклав) приводят к получению продукта с более крупными кристаллами.
[42] Сопутствующая заявка США N 07/745902 с датой подачи
от 16 августа 1991 ( Bhattacharyya et al ) также раскрывает получение соединений типа гидроталькита
В предпочтительном способе крекинга по данному изобретению в соответствующую реакционную
зону подают испаряющееся гидрокарбильное соединение и кислородсодержащий газ, представляющий собой молекулярный кислород или двуокиcь углерода, причем в зоне содержится катализатор, образовавшийся при
термообработке одного или нескольких никельсодеpжащих соединений гидроталькитового типа, описанных выше, и осуществляют взаимодействие гидрокарбильного соединения и кислородсодержащего газа в
присутствии катализатора крекинга при условиях реакции, обеспечивающих получение синтетического газа в виде смеси молекулярного водорода и моноокиси углерода. Мольное отношение водорода к моноокиси
углерода может меняться, однако, обычно оно находится в интервале от 0,1 1 до 5 1.
[43] Гидрокарбильным соединением согласно данному изобретению может быть одно или несколько газообразных
или иcпаряющихся соединений, которые могут реагировать с молекулярным кислородом или двуокисью углерода с образованием синтетического газа. Лучше всего в качестве гидрокарбильного соединения применять
углеводород, однако, различные количества кислорода или других атомов также могут содержаться в молекуле этого соединения. Например, гидрокарбильными соединениями, превращаемыми в синтетический газ,
могут быть метанол, диметиловый эфир, окись этилена и т.п.
[44] Однако наиболее предпочтительными гидрокарбильными соединениями являются низкомолекулярные углеводороды, содержащие 1 20
атомов углерода, предпочтительно, 1-10 атомов углерода. Meтан и природный газ, который в основном содержит метан, легко доступны, недороги и являются самыми предпочтительными гидрокарбильными
соединениями. Могут также быть использованы смеси гидрокарбильных и/или углеводородных соединений.
[45] В качестве кислородсодержащего газа в соответствии с данным изобретением применяют
или газ, содержащий молекулярный кислород, или газ, содержащий двуокись углерода. Газ, содержащий молекулярный кислород, используется для получения синтетического газа путен окисления гидрокарбильного
соединения. Когда в качестве последнего применяют метая, реакция протекает в соответствии со схемой частичного окисления, описываемого следующим уравнением:
СН4 + 1/2 O2
----> СО + 2Н2
Кислородсодержащим газом может быть чистый молекулярный кислород или cмеcь молекулярного кислорода с одним или несколькими другими газами, например, азотом,
гелием, или другими инертными газами. Содержание молекулярного кислорода в кислородсодержащем газе может быть от 1% до 100% предпочтительно, 20-100% наиболее предпочтителем чистый молекулярный
кислород, т.е. содержащий 98% или 99% кислорода. Количество молекулярного кислорода, подаваемого в реактор, содержащий катализатор на основе никельcодержащего предшественника, по отношению к
гидрокарбильному соединению должно быть таким, чтобы было достаточно кислорода для образования синтетического газа. Когда используют метан, мольное отношение молекулярного кислорода к метану в
реакционной смеси, подаваемой в зону реакции, равно 1 2. Однако, если желательна высокая селективность по отношению к синтетичеcкому газу, отношение молекулярного кислорода к метану равно 1 2,1, а
когда желательна полная конверсия метана, оптимальное отношение молекулярного кислорода к метану составляет 1 1,9. Согласно предлагаемому способу, когда гидрокарбильное соединение реагирует с
молекулярным кислородом с образованием синтетического газа, температура реaкции находится в интервале 400-1000oC. Более предпочтительно, 600-900oС. Кроме того, поскольку реакция
гидрокарбильного соединения е молекулярным кислородом является экзотермической, тепло, выделяющееся в процессе реакции, может быть использовано как источник энергии для осуществления других процессов
на химическом заводе. Например, оно может быть использовано для получения пара высокого давления. Давление в процессе реакции гидрокарбильного соединения с молекулярным кислородом находятся в
интервале0.1 -50 абс. атм, предпочтительно, 25 40 абс.атм. Пространственная скорость должна обеспечивать конверсию большей части гидрокарбильного соединения в синтетический газ и,
предпочтительнообъемная скорость находится в интервале 10 1•109час-1, предпочтительно, 1200- 1•106час-1. Объемная скорость рассчитывается на
основе общего объема реагирующих газов, т.е. газообразного гидрокарбильного компонента и газа, содержащего молекулярный кислород, и объема катализатора в реакторе.
[46] Хотя другие исходные
материалы могут быть добавлены вместе с газом, содержащим молекулярный кислород, и гидрокарбильным соединением, (например, вода или пар), это не является необходимым. Одно из преимуществ данного
изобретения при превращении гидрокарбильного соединения в синтетический газ по реакции с молекулярным кислородом заключается в том, что никельсодержащие катализаторы, полученные из предшественников со
структурой типа гидроталькита, препятствуют образованию кокса.
[47] Следовательно, нет необходимости добавлять пар или воду для устранения коксования катализатора. Однако пар или воду можно
добавить для регулировки отношения Н2 к СО в синтетическом газе.
[48] Согласно предлагаемому способу при реакции газа, содержащего двуокись углерода, с гидрокарбильным
соединением, таким газом является 1 100%-ная двуокись углерода, предпочтительно, 20-100%-ная двуокись углерода и наиболее предпочтительно чистая двуокись углерода.
[49] Газ, содержащий
двуокись углерода, может включать другие газы, например, азот, гелий, аргон и т.п. однако, как указано выше, предпочтительно использовать чистый углекислый газ.
[50] Согласно предлагаемому
способу, когда осуществляется крекинг гидрокарбильных соединений с использованием углекислого газа, добавление воды или пара предпочтительно для уменьшения коксования катализатора. Пар должен
присутствовать в количестве, достаточном для контролирования образования и отложения кокса на катализаторе, чтобы не происходила дезактивация. Предпочтительно, количество воды в виде пара составляет
от 10 до 50% от подаваемого газа, более предпочтительно, 20 30% от общего количества подаваемого газа. Для увеличения времени жизни катализатора к исходным газом могут быть добaвлены другие вещества,
например, при осуществлении крекинга в присутствии углекислого газа вместе с исходным газом можно вводить сероводород или другие источники серы, предпочтительно, летучие. Если их вводят, то
сероводород или другие летучие серусодержащие соединения, например, алкилтиол, диалкилсульфид или диалкилдисульфид, присутствуют в исходной смеси в количестве 10 ч. на миллион 100 ч. на миллион от
общего веса исходных газов.
[51] Однако мы определили, что катализаторы по данному изобретению эффективны при крекинге гидрокарбильных соединений без использования серусодержащих
соединений.
[52] Количество углекислого газа по отношению к гидрокарбильному соединению, подаваемого в реактор, содержащий катализатор, должно быть таким, чтобы было достаточное количество
СО2 для эффективного превращения гидрокарбильного соединения в синтетический газ. Обычно цельное отношение двуокиси углерода к углероду в гидрокарбильном соединении составляет, по меньшей
мере, 0,8 1, предпочтительно, 1:1 5 1, наиболее предпочтительно1 1 2 1.
[53] Температура реакции крекинга гидрокарбильного соединения с использованием СО2 обычно находится в
интервале 750 950oС, предпочтительно,850 900oС. Давление составляет0,1-50 абс.атм, предпочтительно, 10 - 35 абс.атм. Скорость потока реакционной смеси, проходящей через данный
объем, такова, что она обеспечивает конверсию большей части гидрокарбильного соединения, предпочтительно, метана, в синтетический газ. Объемные скорости потока находятся в интервале 1000 1•
106 час-1, предпочтительно 1•104 1•105 час-1. Объемно скорости потока рассчитываются на общий объем газа, подаваемого в реактор,
содержащего катализатор, и объем катализатора.
[54] Никельсодержащие соединения, описанные в данной заявке, полученные термообработкой некельсодержащих гидроталькитоподобных соединений,
также можно использовать при паровом крекинге гидрокарбильного соединения в случае применения в качестве кислородсодержащего газа водяного пара. Предпочтительно в качестве гидрокарбильного соединения
использовать метан или природный газ. Температура реакции парового крекинга обычно выше 700oС, более предпочтительно, по меньшей мере, выше 720oС, еще лучше 800-1000o
C. давление составляет 0.1-75 абc.атм. Скорость потока газа при паровом крекинге должна обеспечивать конверсию большей части гидрокарбильного соединения в синтетический газ. Объемные скорости потока
газа равны 1000-1•106час-1, предпочтительно 1•104 1•105чаc-1. Объемные скорости рассчитываются на общий объем газа,
поступающего в реактор, содержащий катализатор, и объем катализатора. Мольное отношение воды к углероду в подаваемом газе находится в интервале от~ 10: 1 до2 1, предпочтительно, от 8:1 до 3 1. Однако
преимущество катализаторов по данному изобретению заключается в том, что они не склонны к кокcованию. Соответственно, мольные отношения воды (пара) к углероду в гидрокaрбильном компоненте могут быть
низкими, например, меньше 2 1, предпочтительно, менее 1,6 1, наиболее прeдпочтительно, меньше 1 1. Возможность использования низких молярных отношений воды к углероду желательно, т.к. синтетический
газ характеризуется низким отношением водорода к моноокиси углерода. Активные катализаторы крекинга по данному изобретению, полученные в процессе крекинга, состоят из частиц металла, включающих, по
меньшей мере, никель (никель в нулевой стадии окисления) и один или несколько металлов, выбранных из группы: Сu, Со, Mn, Pd, Pt, Zn, в нулевой стадии окисления, причем частицы металла в нулевой стадий
окисления частично, почти полностью или, предпочтительно, полностью окружены кристаллитами, имеющими структуру шпинели.
[55] Кристаллиты шпинели состоят или M3+2O3 и/или M2+M3+2O4 ,,
где М2+ металл в +2 форме окисления и, предпочтительно выбран из группы: Mg2+, Zn2+, Ni2+, Fe2+, Cu2+, Co2+, Mn2+, Pd2+ или Pt2+,
а M3+ металл в +3й форме окисления и, предпочтительно, по меньшей мере, один из группы: Ai3+, B3+, Cr3+, Fe3+, Ga3+, Jn3+, La3+, Ni3+, Co3+, Mn3+, Rh3+, Ti3+,
V3+
и ионы трехвалентного лантана. Более предпочтительно, чтобы М3+ в шпинелях представлял собой А13+ и более предпочтительно, чтобы М2+, если он
содержится, являлся Mg2+. Частицы металла имеют размер в интервале от 1 до 1000 им, предпочтительно, 10-500 им. Атомное отношение никеля к другим металлам, если они присутствуют, в частицах
металла обычно в интервале от 100:1 до 0,05:1,предпочтительно, 5:1 0,1:1. Кристаллиты шпинели обычно имеют размер около 200 нм, предпочтительно, не более 60 нм. Наиболее предпочтительны кристаллиты
шпинели размером 5 30 нм. Мольное отношение металлов в нулевой стадии окисления к шпинели в активном катализаторе крекинга обычно составляет от 20: 1 до1:20. В контексте данного описания при описании
кристаллитов шпинели окружающих активный катализатор, по большей частя означает в среднем, по меньшей мере, 50% площади внешней поверхности частиц металла, "в основном" означает в среднем, по меньшей
мере, 80% площади внешней поверхности частиц металла, и "полностью" означает в среднем 95-100% площади внешней поверхности частиц металла. При описании активного катализатора термин "кристаллит"
означает маленькие кристаллы. Шпинели являются хорошо известными кристаллическими структурами и описаны, например, в А.F.Well "Structural Jnorganic Chemistly", Glared Press, Oxford, 1987.
[56] Активный катализатор крекинга по большей части получают путем обработки в условиях реакции крекинга никельсодержащих гидроталькитоподобных композиций, описанных в этом описании,
предпочтительно, в условиях реакции, используемых для получения синтетического газа взаимодейcтвием гидрокарбильного соединения с молекулярным кислородом или двуокисью углерода.
[57] Тип
реактора для осуществления способа по изобретению может быть любым, который применяется для осуществления реакции в газовой фазе над гетерогенным твердым катализатором. Например, реактор с неподвижным
слоем, реактор с движущимся слоем и т.п. Каталитические композиции в соответствии с данным изобретением можно применять как таковые или они могут быть на одном или более носителях, например, на
α-окиси алюминия, кремнеземе и др. Предпочтительно, каталитические композиции на носителе или без него получают в виде, подходящем для проведения реакции в газовой фазе, например, в виде сфер,
цилиндрических частиц кольцеобразных частиц и т.д.
[58] Подробное описание рисунков
На рис. 1 представлена фотомикрография никельсодержащего катализатора по данному изобретению.
Фотомикрография была получена с использованием электронного микроскопа с высокой степенью разрешения JEOL JEM2000 ЕХ при 200 kv.
[59] Тонкие образцы (~ 20-40 им толщиной) катализатора
подвергают анализу. На этом рисунке показана [011] проекция типичного микрокристалла в катализаторе.
[60] В центральной части кристалла сосуществуют двухфазные домены кубическая центральная
структура NiО (FСС, симметрия кристалла Fm 3m ) с константой решетки, а 4,8 ангстрем и NiAl2O4 со структурой шпинели (симметрия кристалла Fd3m ) c константой решетки а 8,05
ангстрем (константы решеток вычислены по фотомирографии).
[61] Две фазы cоотноcятcя эпитaксиально ( [1,1,1] NiO параллельна [ 1,1,1] шпинели), эпитаксиальные межфазные поверхности указаны
стрелками. Каталитическая композиция, изображенная на рис.1, получена прокаливанием Ni4Al2OH12CO3•4H2O при 850oС на воздухе.
Эта композиция соответствует описанной в примере 8.
[62] На рис. 2 представлена фотомикрография (полученная, как и в случае, показанном на рис.1) тонкого образца катализатора, показанного
на рис.1, после того, как катализатор использовали в течение 1 дня в качестве катализатора СО2 крекинга для конверсии метана в синтетический газ. Этот рисунок показывает, что структура
изменилась, включив частицы металлического никеля (FСС, симметрия Fm3m и а 3,52 ангстрема). Частицы никеля окружены или "украшены" кристаллитами шницели окиси алюминия (Fd3m, a=7,911 ангстрем) с
размером 10-20 нм. Стрелки показывают двойниковый кристалл в одной из частиц никеля.
[63] Рис. 3 показывает в схематическом виде структуру никельсодержащих катализаторов во время
использования их в качестве катализатора СО2 - крекинга. На рисунке схематически представлены результаты проведенных с помощью электронной микроскопии анализов. Как показано на рис.2,
катализатор через 1 день включает частицы никеля размером 25-200 нм. Частицы никеля свидетельствуют о некотором образовании кокса, т.е. примерно одна из 20 частиц никеля имеет очень тонкое покрытие из
графита. Частицы с покрытием из графита это обычно те частицы, которые не окружены кристаллитами шпинели. Как показано на рис. 2, частицы никеля"украшены" шпинельными кристаллитами на основе Al2О3. Катализатор после одного дня работы также содержит небольшое количество гексагональных пластин окиси алюминия. Через 5 дней работы размер частиц никеля увеличился до 50-400 нм.
Однако коксование частиц никеля уменьшилось. Таким образом, катализатор продемонстрировал удивительную устойчивость к образованию кокса. Через 14 дней работы образование кокса еще было незначительным,
как и после 5 дней работы. Размер частиц никеля оставался равным 50-400 нм. Катализатор также содержит небольшое количество гексагональных пластинок окиси алюминия. Уникальная структура катализатора,
когда частицы никеля "украшены" шпинелью окиси алюминия, отвечает за незначительное коксование металлического никеля.
[64] Нижеследующие примеры иллюстрируют некоторые формы выполнения
изобретения, но не ограничивают объем изобретения.
[65] Пример 1. В 3-х гордую круглую колбу объемом 1 л, снабженную термометром, обратным холодильником и механической мешалкой, загружают
400 мл деионизированной воды 7,95 г (0,075 мол) NaCO3 и 24,0 г (0,6 мол) гранул NaOH. Готовят второй раствор, содержащий 10,91 г (0,0375 м) Ni(NO3)2•6Н2О, 48,08 г (0,1875 мол) Mg(NO3)2•6Н2О и 28,14 г (0,075 мол) Al(NO3)3. 9 H2O и 375 мл воды, и по каплям добавляют к
первому раствору при перемешивании в течение 1 часа. После завершения добавления гелеобразную cмесь (pH= 8,9) нагревают в течение 15 час при 80-85oС. Охлажденную cмеcь фильтруют, несколько
раз промывают водой и сушат ночь под вакуумом при 70oС. XRD cвидетельствует о типичной для гидроталькита структуре с d(001)= 7,7 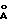 . Этот продукт соответствует формуле
. Этот продукт соответствует формуле
[NiMg5Al2(OH)16]CO3•4H2O
Пример 2. Продукт, описанный
в примере 1, прокаливают, помещая взвешенное количество продукта в обжигательную печь и поднимая температуру со скоростью 20oС/мин, пока не доcтигнут температуры 450-500oС.
Продукт выдерживают при этой температуре 15 час и затем разделяют на различные фракции ситами. Фракции затем прокаливают при 850oС.
[66] Пример 3. В 3-х гордую круглую колбу
объемом 1 л, снабженную термометром, обратным холодильником и механичеcкой мешалкой, загружают 400 мл деионизированной воды, 7,95 г (0,075 мол) NaCO3 и 18,0 г (0,45 мол) гранул NaOH.
Приготавливают второй раствор, содержащий 10,92 г (0,0375 мол) Ni(NO3)2•6H2O, 28,85 г (0,1125 мол) Mg(NO3)2•6H2O и 28,14
г (0,075 мол) Al(NO3)3•9H2O и 375 мл воды и по каплям добавляют его к первому раствору в течение 1 часа при перемешивании. Далее процедуру продолжают как в
примере 1. Полученный продукт соответствует формуле NiMg3Al2(OH)12CO3•4H2O.
[67] Пример 4. Продукт, описанный в примере 3,
прокаливают, помещая взвешенное количество образца в обжигательную печь и поднимая температуру со скоростью 20o/мин пока температура не станет равной 450-500oC. Продукт
выдерживают при этой температуре в течение 15 час и фракционируют при помощи сит. Фракции затем обжигают при 850oС.
[68] Пример 5. В трехгорную колбу объемом 1 л, снабженную
термометром, обратным холодильником и механической мешалкой, загружают 400 мл деионизированной воды, 10,6 г (0,1 мол) NaCO3 и 24,0 (0,6 мол) гранул NaOH. Готовят второй раствор, содержащий
29,08 г (0,1 мол) Ni(NO3)2•6H2O, 25,04 г (0,1 мол) Mg(NO3)2•6H2O и 37,51 г (0,1 мол) Al(NO3)3
•9H2O и 375 мл воды, и по каплям добавляют его к первому раствору при перемешивании в течение 1 часа. После окончания добавления, желеобразную смесь (pH=8.5) нагревают в течение 15
час при 80-85oС. Затем охлажденную смесь фильтруют, многократно промывают водой и сушат вею ночь под вакуумом при 70oС. XRD) продукта свидетельствует о типичной для гидроталькита
структуре с d(001)=7,6  . Этот продукт соответствует формуле [Ni2Mg2Al2(OH)12] СО34H2O.
. Этот продукт соответствует формуле [Ni2Mg2Al2(OH)12] СО34H2O.
[70] Соединение, описанное в примере 5, прокаливают, помещая взвешенное количество образца в печь для обжига и поднимая
температуру со скоростью 20o/мин до 450-500oС. Затем продукт выдерживают при этой температуре 15 час и фракционируют на сите 12-20 мин. Затем продукт прокаливают при 850oС. XRD этого катализaтора показывает только слабые пики вследствие наличия NiO.
[71] Пример 7. В трехгорлую круглую колбу объемом 1 л, снабженную термометром, обратным холодильником
и механической мешалкой, загружают 400 мл деионизированной воды, 7,95 г (0,075 мол) NaСО3 и 18,0 (0,45 мол) гранул NaOH. Готовят второй раствор, содержащий 43,62 г (0,15 мол) Ni(NO3)2•6H2O и 28,13 г (0,075 мол) Al(NO3)3•9H2O и 375 мл воды, и по каплям добавляют к первому раствору при перемешивании в
течение 1 часа. После окончания добавления желеобразную смесь нагревают в течение 15 час при 80-85oC. Затем охлажденную cмеcь фильтруют, многократно промывают водой и сушат ночь под
вакуумом при 70oС. XRD продукта свидетельствует о структуре гидроталькита с d(001)= 7,6
 . Продукт
соответствует формуле:
. Продукт
соответствует формуле:
[Ni4Al2(OH)12 СО34H2O.
[72] Пример 8. Продукт, описанный в примере 7, прокаливают взвешенное
количество образца в печи для обжига, повышая температуру со скоростью 20o/мин до 450-500oС. Продукт выдерживают при этой температура в течение 15 час и рассеивают на бите 12-20
мин. XRD продукта дает слабые пики благодаря наличию NiO дальнейшее прокаливание этого продукта до 850oС не изменяют природы этого продукта, как свидетельствует XRD.
[73] Пример
9. В трехгорлую круглую колбу объемом 1 л, снабженную термометром, обратным холодильником и механической мешалкой, загружают 400 мл деионизированной воды, 5,30 г (0,05 мол) NaCO3 и 18,0 г
(0,45 мол) гранул NаОH. Готовят раствор, содержащий 43,62 г (0,15 мол) Ni(NO3)2•6H2O и 18,76 г (0,05 мол) Аl(NO3)3•9H2O
и 375 мл воды, и по каплям добавляют его к первому раствору при перемешивании в течение 1 час. После окончания добавления желеподобную смесь (pH=8.2) нагревают в течение 15 час при 80-85oС.
Охлажденную смесь отфильтровывают, многократно промывают водой и сушат в течение ночи под вакуумом при 70oС. XRD продукта показывает образование структуры типа гидроталькита с d (001)= 7,9
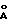 . Этот продукт соответствует формуле Ni6Al2(OH)16CO3•4H2O
. Этот продукт соответствует формуле Ni6Al2(OH)16CO3•4H2O
Пример 10. Продукт, описанный в примере 9, прокаливают, помещая взвешенное количество материала в печь и повышая температуру со скоростью 20o/мин до 450-500oС.
При этой температуре материал выдерживают в течение 15 час и рассеивают на ситах. Фракции затем прокаливают при 850oС.
[74] Пример 11. Повторяют пример 9 за исключением того, что
количество Ni(NO3)2•6H2O равно 0,2 моля вместо 0,15 мол. Этот продукт соответствует формуле Ni8Al2(OH)20O - CO3
•H2O.
[75] Пример 12. Продукт, описанный в примере 11, прокаливают, помещая взвешенное количество образца в печь и поднимая температуру со скоростью 20o/мин до
450-500oС. Продукт выдерживают при этой температуре в течение 15 час и затем фракционируют на ситах разного размера. Фракции прокаливают при 850oС.
[76] Пример 13. В
трехгорлую круглую колбу объемом 1 л, снабженную термометром, обратным холодильником и механической мешалкой, загружают 400 мл деионизированной воды, 7,95 г (0,075 мол) NaCO3 и 18,0 г (0,45
мол) гранул NaOH. Готовят второй раствор, содержащий 21,81 г (0,075 мол) и Ni(NO3)2•6H2O, 17,44 г (0,075 мол) Cu(NO3)2•6Н2О и 28,14 г (0,075 мол) Аl(NO3)3. 9 H2O и 375 мл воды, и по каплям добавляют и первому раствору при перемешивании при 80-85oC. Затем охлажденную
смесь фильтруют, многократно промывают водой и сушат в течение ночи под вакуумом при 70oС. ХRD продукта cвидетельcтвует об образовании структуры типа гидроталькита с d(001)=7,5 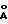 Продукт соответствует формуле Cu2Ni2Al2(OH)12• 4 H2
O.
Продукт соответствует формуле Cu2Ni2Al2(OH)12• 4 H2
O.
[77] Пример 14. Продукт, полученный в примере 13, прокаливают, помещают взвешенное количество образца в лечь и повышая температуру со скоростью 20o/мин до 450-500o
С. Продукт выдерживают при этой температуре 15 час и рассеивают на нескольких битах с ячейками разного размера. Фракции затем прокаливают при 850oС.
[78] Пример 15. В трехгорлую
круглую колбу объемом 1 л, снабженную термометром, обратным холодильником и механической мешалкой, загружают 400 мл деионизированной воды и 19,8 г (0,495 мол) гранул NaОН. Готовят второй раствор,
содержащий 31,99 г (0,11 мол) Ni(NO3)2•6 H2O и 41,27 г (0,11 мол) Al(NO3)3•9 H2O и 340 мл воды, и по каплям добавляют
его при перемешиваний к первому раствору в течение 1 часа. В этот момент рН смеси равен 9,3. После окончания добавления желеподобную смесь нагревают в течение 15 час при 80-85oС. Затем
охлажденную смесь фильтруют, многократно промывают водой и в течение ночи сушат под вакуумом при 70oС. XRD продукта не обнаруживает обычной гидроталькитовой структуры. Этот продукт
прокаливают при 700oС с получением шпинели Ni2Al2O5 с высоким содержанием
Пример 16. В трехгорлую круглую колбу объемом 1 л, снабженную термометром,
обратным холодильником и механической мешалкой, загружают 400 мл деионизированной воды и 22,4 г (0,56 мол) гранул NaOH. Готовят второй раствор, содержащий 20,37 г (0,07 мол) Ni(NО3)2•6 H2O и 52,53 г (0,14 мол) Al(NO3)3•9 H2O и 340 мл воды,и по каплям добавляют его к первому раствору в течение 1 часа при
перемешивании. В этот момент рН смеси равен 10,3. Для понижения рН до 9,5 добавляют несколько капель HNО3. После окончания добавления желеподобную смесь нагревают в течение 15 час при
80-85oС. Охлажденную смесь фильтруют, многократно промывают водой и сушат в течение ночи под вакуумом при 70oС. XRD продукта не обнаруживает структуры типа гидроталькита. Продукт
прокаливают при 800oС с получением шлинели NiAl2O4
Пример 17. Промышленный катализатор на основе Ni просеивают на сите 40/60 мин и используют.
[79]
Пример 18. Промышленный катализатор на оcнове Ni, отличающийся от катализатора в примере 17, просеивают на сите 40/60 мин и используют.
[80] Пример 19. В трехгорлую круглую колбу объемом 0,
5 л, cнабженную термометром, обратным холодильником и механической мешалкой, загружают 200 мл деионизированяой воды, 10,6 г (0,075 мол) NaCO3 и 28,0 г (0,7 мол) гранул NaOH, 51,3 г
Mg(NO3)2•6 H2O, 37,5 г Al(NO3)3•9 H2O и 160 мл воды, и по каплям добавляют его к первому раствору при перемешивании в
течение 1 часа. После окончания добавлении желеподобную смесь нагревают в течение 15 час при 80-85oС. Охлажденную смесь затем фильтруют, многократно промывают водой и сушат в течение ночи
под вакуумом при 70oС. XRD продукта показывает, что образовалась структура типа гидроталькита с d(001)=7,6 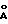 .
.
[81] Пример 20. Продукт, описанный в примере 19, прокаливают, помещая взвешенное количество образца в печь и повышая температуру со скоростью 20o/мин до 450-500oС. Продукт выдерживают при этой температуре 15 час и просеивают на ситах разного размера. Эти фракции затем прокаливают при 850oС.
[82] Пример 21. Катализаторы, полученные
или описанные в вышеприведенных примерах, оценивают в процессе образования синтетического газа частичным окислением метана.
[83] Оценка проводится с использованием аппарата, состоящего из
кварцевой трубки-реактора диаметром 16 мм и длиной 30,48 см, смонтированной вертикально в трехзонной печи.
[84] Каждая зона имеет длину 5,08 см. В центре трубки-реактора расположена
кварцевая трубка диаметром 4 мм. В трубку-реактор загружают 4 мл катализатора и, используя пробки из кварцевой ваты, размещают в центральной нагревательной зоне печи слой катализатора. Внутри
4-миллиметровой трубки помещают три термопары: одну наверху, другую в середине и третью на дне слоя катализатора. Газ, используемый для оценки, представляет собой смесь 7,5% кислорода (02)
и 15% метана в среде азота. Азот поддерживает смесь снаружи взрывчатого конверта и также служит внутренним стандартом для анализа смеси методом газовой хроматографин. Оценка превращения метана в
синтетический газ проводится при атмосферном давлении и вышеописанный аппарат сконструирован так, что отключается автоматически, когда давление превышает 30'' воды. Хроматографический анализ
осуществляют автоматически с интервалами 20-30 час.
[85] В нижеследующих таблицах приведены не все полученные данные, скорее они содержат данные, полученные в начале, середине и в конце
проведения измерений. Образование водорода определяют методом газовой хроматографии, а гелий используют в качестве носителя (используют детектор теплопроводности). Соответственно, величины,
приведенные в таблицах для водорода, имеют погрешность ±10% Кроме того, селективность, указанная для водорода, больше 100% т.к. теоретически возможны два моля водорода на каждый моль метана,
превращаемого в синтетический газ частичным окислением молекулярным кислородом.
[86] Для каждого опыта в таблицах указаны температура реакции, скорости течения, пространственная скорость и
время пребывания.
[87] В табл. 1-8 приведены результаты, полученные при получении синтетического газа окислением метана в присутствии катализаторов по изобретению. В частности, в таблицах 1
и 2 показаны результаты с использованием катализатора на основе соединении формулы NiM5Al2(OH)16CO3 полученного по примеру 2.
[88] В таблице 3
показаны результаты использования катализатора на основе соединения формулы NiMg3Al2(OH)12CO3, полученного по примеру 4. В таблице 4 приведены результаты от
использования катализатора основе соединения с гидроталькитовой структурой формулы Ni2Mg2Al2(OH)12CO3, полученного по примеру 6. Эти данные
показывают, что кaтализаторы, содержащие никель, магний и алюминий, полученные из предшественников гидроталькитового типа, все имеют превосходную каталитическую активность при конверсии метана в
синтетический газ частичным окислением, и не образуют кокс во время испытаний.
[89] В табл. 5-7 приведены данные по получению синтетического газа с применением катализаторов, полученных из
Ni4Al2(OH)12CO3, Ni6Al2(OH)16CO3 и Ni8Al2(OH)20CO3, приготовленных
соответственно по примерам 8, 10 и 12. Эти данные свидетельствуют о том, что катализатор на основе Ni4Al2(OH)12CO3 является прекрасным катализатором для
получения спи-газа частичным окислением метана. Два других катализатора, тоже бывшие активными, не сохраняют свою активность, дик другие. В табл. 8 приведены данные для катализатора, полученного по
примеру 14 из Cu2Ni2Al2(OH)12CO3 со структурой типа гидроталькита. Этот катализатор также проявляет превосходные свойства при получении
синтетического газа из метана и кислорода.
[90] В табл. 9-12 показаны данные по конверсии метана в синтетический газ с использованием других никельсодержащих соединений. В табл. 9 приведены
данные для катализатора, полученного по примеру 15, являющегося шпинелью. Хотя вначале получение синтетического газа происходило эффективно, через 16 часов работы шпинельный катализатор
дезактивировался.
[91] В табл. 10 приведены данные для катализатора NiO/Al2O3, полученного по примеру 16. Этот катализатор обеспечивает низкую конверсию метана в
синтетический газ по сравнению с другими катализаторами по изобретению. В табл.11 собраны данные для промышленного катализатора Ni на окиси алюминия (пример 17). Хотя вначале получение сингаза шло
эффективно, после 55 час работы произошла дезактивация катализатора. В табл. 12 показаны результаты испытания другого промышленного никельсодержащего катализатора, использованного для парового
крекинга углеводородов. При использовании для частичного окисления метана, он вначале обеспечивает высокую степень конверсии метана в синтетический газ, однако дезактивируется быстро через 26 час
работы.
[92] В табл. 13 приведены разультаты получения синтетического газа с использованием катализатора на основе Mg4Al2(OH)12CO3, полученного
во примеру 20. Эти данные показывают, что катализатор, приготовленный из cоединения c гидроталькитовой структурой содержащий Мg и Аl, но не содержащий никеля, не является таким селективным
катализатором при получении сингаза частичным окислением метана, как катализаторы, содержащие и никель.
[93] Пример 22. Исследуют катализатор- рутений на окиси титана (0,1% вес. рутения) в
процессе образования синтетического газа в аппарате с использованием исходных материалов и методов анализа, описанных в примере 21. Температура реакции равна 750oС, объем катализатора 4,0
мл, скорость потока газа 102,1 мл/мин, скорость прохождения потока через данный объем равна 1,53•103час-1, весовая скорость прохождения потока равна 1,83•103 млг/час, время пребывания равно 0,251 с.
[94] Через 284,25 час работы, конверсия метана равна 53,11% и конверсия О2 составляет 99,78%
Селективности имеют
следующие значения:
Селективность. мол.
[95] Н2 109,40
СО 59,09
СО2 40,91
Н2/СО 1,85
Таким образом, хотя
катализатор на основе рутения не коксуется во время испытаний, катализаторы по изобретению обеспечивают большие степени конверсия метана и селективность по отношению к синтетическому газу.
[96] Пример 23. Катализатор рутений на окиси титана (0,5% вес. рутения) исследуют в процессе образования синтетического газа как в примере 22. Температура реакции равна 750,8oС, объем
катализатора 4,0 мл, скорость потока исходного газа равна 101,6 мл/мин, скорость прохождения потока через данный объем 1,52•103час-1, весовая скорость прохождения через
данный объем 1,76•103млг/час, время пребывания 0,252 с. Через 279•55 час работы конверсия метана равна 71,53% и конверсия 02 99,75%
Селективности имеют
следующие значения:
Селективность. мол.
[97] Яд 140,93
СО 80,65
СО2 19,35
Н2/СО 1,75
Как и в примере 22, катализатор на
основе рутения не коксуется во время испытаний, однако, катализаторы по изобретению превосходят этот катализатор в процессе образования синтетического газа окислением метана.
[98] Методика
примеров 24-30.
[99] Катализаторы по данному изобретению, другие никельсодержащие катализаторы и катализатор на основе молибдена исследуют в процессе конверсии метана в синтетический газ,
используя двуокись углерода как источник атомов кислорода.
[100] Эти исследования проводят используя одноходовой реактор с неподвижным слоем, содержащий кварцевую трубку размером 9 мм 11 мм
76,20 см с надрезами, расположенными на расстоянии 10,16 см от нижнего конца трубки. Реактор работает с потоком, направленным вниз, а для поддержания изотермических условий применяют трехзонную печь.
Пар и конденсируемые углеводороды собирают в холодной ловушке. Скорости потока выходящего газа измеряют счетчиком. Сероводород, если он присутствует, удаляют из потока при помощи мокрого скруттера.
Анализы проводят методом газовой хроматографии.
[101] В процессе исследования с использованием двуокиси углерода, если не оговорено иного, температура реакции равна 81oС,
объемная скорость прохождения газа через данный объем разна 7200 час-1 при STP, давление равно 300 Ф/дюйм2 (2068,4 кПа), отношение СО2 к метану в исходном газе равно
1:25, отношение воды к метану равно 1,0. Сероводород (если он вводится) присутствует в исходном газе в количестве 27 ч. на миллион (по объему).
[102] При этих отношениях компонентов
исходного газа, исходный газ при проведении реакций крекинга с использованием С2, имеет следующий состав, об.
[103] СО2 38,4
СH4 30,8
H2О 30,8
H2 27 ч. на миллион.
[104] Пример 24. "Гидроталькитоподобный" катализатор, полученный по примеру 8, пропущенный через сито 80-100 мин, испытывают в
процессе крекинга метана с помощью C2. В исходном газе была низкая концентрация сероводорода (H2S). Результаты приведены в табл.14 и эти данные показывают эффективность
катализатора в процессе крекинга с использованием CO2. Степени конверсии метана и CO2 соответственно равны 76% и 41% Селективность углерода к моноокиси углерода равна 99,5%
Пример 25. В табл.14 показаны результаты крекинга метана с использованием CО2 в присутствии коммерческого никельсодержащего катализатора крекинга. Результаты подобны данным примера 24,
однако конверсия CО2 была ниже.
[105] Пример 26. В таблице 14 приведены результаты крекинга метана с использованием C2 в присутствии катализатора-сульфида молибдена
при тех же условиях и исходных соединениях, что и в примерах 24 и 25. Конверсия метана и C2 была значительно ниже по сравнению с примерами 24 и 25.
[106] Пример 27. Никелевый
катализатор по изобретению, полученный по примеру 8, испытывают в тех же условиях, что и в примерах 24-26, однако, в исходном газе не содержался сероводород. Данные этого опыта также включены в
таблицу 14. Конверсия метана и двуокиси углерода достаточно высока 77% и 40% соответственно. Селективность углерода по отношению к моноокиси углерода равна 99,5%
Отношение воды к метану
уменьшают до 0,5 для оценки влияния концентрации воды в исходном газе. Температуру реакции затем повышают до 867oС. Данные этих опытов приведены в таблице 15.
[107] Уменьшение
количества воды приводит к увеличению конверсии СО2 от 40% до 52% и уменьшению отношения водорода к моноокиси углерода в синтетическом газе. Более высокая температура реакции приводит к
увеличению конверсии метана и СО2 до 82% и 60% соответственно. Следовательно, низкое отношение воды к метану и высокая температура реакции приводят к максимальной конверсии CО2
.
[108] Пример 28. Изучают поведение коммерческого никельсодержащего катализатора с использованием низких отношений воды к метану и повышенных температур реакции. Эти данные также приведены
в таблице 15.
[109] Пример 29. Крекинг метана с использованием двуокиси углерода осуществляют в присутствии физической смеси окиси никеля на α -окиси алюминия. Каталитическая
композиция содержит 75 вес. NiO. Были использованы те же условии реакции, что и в примерах 24-26, но без сероводорода в исходной газовой смеси. Данные в таблице 14 показывают, что степени конверсии
метана и СO2 составляют только 30% и 11% соответственно.
[110] Пример 30. Никелевая шпинель, полученная по примеру 16, используется в качестве катализатора крекинга при получении
синтетического газа реакцией двуокиси углерода с метаном. Условия реакции те же самые, что и в примерах 24-26, но в исходное газовой смеси не содержится сероводорода. Данные в таблице 14 показывают,
что шпинель через 100 час работы остается эффективным катализатором крекинга метана с использованием СО2. Степени конверсии метана и СО2 составляют 86% и 47% соответственно.
Селективность по моноокиси углерода равна 99,5%
Пример 31. Катализатор по изобретению, полученный из никельсодержащей гидроталькитоподобной композиции [NiAl2(ОН)12]
CO2•4 H2O, сравнивают с коммерческим никельсодержащим катализатором крекинга метана с использованием СО2. При проведении сравнения меняют объемную скорость
прохождения потока газа (GHSV) через данный объем и, как видно из таблицы 16, катализатор по изобретению является более активным конверсия метана при высоких скоростях газового потока значительно выше,
чем для коммерческого катализатора.
[111] При проведении этого исследования катализатор (0,02 см3) разбавляют 50 вес. ч. a-окиси алюминия на 1 вес.ч. катализатора. Кроме того, носитель
катализатора имел один слой окиси алюминия толщиной 2,54 см и второй слой окиси алюминия толщиной 0,63 см. Отношение СО2 к метану в исходном газе составляет 1,2, отношение воды к метану
равно 1,0 и исходный газ на 50% разбавляют азотом. Давление равно 100 Ф/дюйм2 (689407,6 н/м2), температура реакции указана в таблице 16.
[112] Пример 32. Метан
подвергают крекингу с использованием катализатора, полученного по примеру 8. Используют тот же реактор, который описан в примерах 24-30.
[113] В реактор загружают 0,33 г (0,5 см3
) катализатора (40-60мин), носитель катализатора предварительно обрабатывают в течение 18 час при 850oС потоком воды, водорода и азота со скоростью потока 28800 (объем газа/объем
катализатора/час при нормальных давлении и температуре). Объемное отношение воды, водорода и азота составляет 109,1:10,9:120 соответственно. После этой предварительной обработки используют исходный
газ с мольным отношением метана и воды 50/50 при скорости потока газа 120 с см3. После работы при этих условиях состав газа, выходящего из реактора (в расчете на сухой остаток) следующий,
мол.
[114] Метан 6,6
Моноокись углерода 22,2
Водород 69,1
Двуокись углерода 2,1
Мольное отношение
Н2/СО 3,1
Этот пример
показывает, что катализатор по изобретению эффективен в процессе парового крекинга метана при низких отношениях воды (пара) к метану. Используя это низкое отношение, получают низкое мольное отношение
(3:1) к моноокиси углерода в получаемом синтетическом газе.
[115] Во время этого опыта не происходит образования кокса. В отчет о поиске включено полное описание заявки США на патент N
07/993419 с датой подачи 21.12.1992 г.
[116] Некоторые формы воплощения данного изобретения описаны выше. Однако специалисту в данной области очевидно, что возможны другие варианты и
различные модификации. Эти варианты и модификации следует рассматривать как эквиваленты в объеме данного изобретения. ТТТ15 ТТТ16


 . В зависимости от размера аниона молекулы могут характеризоваться величинами d
(001), равными до 15
. В зависимости от размера аниона молекулы могут характеризоваться величинами d
(001), равными до 15 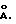 . Величина d (001) является показателем внутрислойного пространства в гидроталькитоподобных
материалах.
. Величина d (001) является показателем внутрислойного пространства в гидроталькитоподобных
материалах.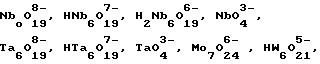 , анионы Кеггина, например, PW11O
, анионы Кеггина, например, PW11O . Этот продукт соответствует формуле
. Этот продукт соответствует формуле . Этот продукт соответствует формуле [Ni2Mg2Al2(OH)12] СО34H2O.
. Этот продукт соответствует формуле [Ni2Mg2Al2(OH)12] СО34H2O. . Продукт
соответствует формуле:
. Продукт
соответствует формуле: . Этот продукт соответствует формуле Ni6Al2(OH)16CO3•4H2O
. Этот продукт соответствует формуле Ni6Al2(OH)16CO3•4H2O Продукт соответствует формуле Cu2Ni2Al2(OH)12• 4 H2
O.
Продукт соответствует формуле Cu2Ni2Al2(OH)12• 4 H2
O. .
.
