[2]Настоящее изобретение относится к биологии, химии и биотехнологии, а именно к биолюминесцентной системе червя Chaetopterus variopedatus.
[4]Биолюминесценция - процесс излучения света живыми организмами в ходе биохимической реакции, в которой химическая энергия превращается в световую. Способность к биолюминесценции определяется наличием специфического белка люциферазы или фотопротеина. Люциферазы - это ферменты, которые катализируют окисление низкомолекулярных соединений - люциферинов, превращая их в оксилюциферины. Окисление сопровождается выделением света и высвобождением оксилюциферина. Способностью к биолюминесценции обладают организмы, принадлежащие к самым разным систематическим группам. Механизмы известных биолюминесцентных реакций весьма разнообразны.
[5]Например, у ряда морских кишечнополостных описаны системы, включающие белки семейства экворина (Prasher, et al., Biochem. 1987, 26:1326-1332; Tsuji et al., Photochem Photobiol, 1995 62(4):657-661). Это семейство фотопротеинов, содержащих ковалентно связанный с ними люциферин, который в присутствии ионов Са2+ подвергается химическим превращениям с образованием продукта в возбужденном электронном состоянии.
[6]Морские полихеты вида Chaetopterus variopedatus широко распространены в различных частях океана, включая побережья Новой Зеландии, Австралии, Японии и Бразилии. Это фильтрующий червь, живущий на мелководье в U- образной трубке, оба конца которой торчат из морского дна. При физическом стрессе червь излучает вспышку голубого цвета и выделяет светящуюся голубую слизь при более агрессивном воздействии, что свидетельствует о том, что нервная система червя контролирует его люминесцентную активность (Jeremy D. Mirza et al, Photochem. & Photobiol. Photochemistry and Photobiology. 2020, 10.1111/php.13221).
[7]Компоненты биолюминесцентных систем (люциферазы, фотопротеины, люциферины и т.д.) - широко используемые реагенты для множества анализов, включая диагностические системы, системы контроля качества и т.д. Например, белки семейства экворина широко используются для исследований высвобождения и связывания Са2+ в биологических системах, например, во время мышечного сокращения. Использование биолюминесцентных систем в подробностях описано, например, в Cormier, М.L. et al., Photochem. & Photobiol. 49/4, 509-512 (1989), Smith, D.F. et al. in ′′Bioluminescence and Chemiluminescence: Current Status (P. Stanley & L. Krick, eds.), John Wiley and Sons, Chichester, U.K. 1991, 529-532.
[8]Несмотря на большое количество биолюминесцентных систем, используемых на сегодняшний день, сохраняется потребность в расширении линейки люциферин-люциферазных пар, обладающих новыми свойствами. Расшифровка новых компонентов биолюминесцентных систем позволяет расширить спектр доступных анализов и приложений для использования.
[10]Задачей настоящего изобретения является установление компонентов биолюминесцентной системы червя Chaetopterus variopedatus, в частности идентификация молекул субстратов биолюминесцентной реакции (люциферинов), а также разработка способа выявления люциферазы в биологическом образце с помощью люциферинов червя Chaetopterus variopedatus и способа детекции биолюминесценции посредством субстратов биолюминесцентной реакции (люциферинов) червя Chaetopterus variopedatus.
[11]Технический результат состоит в расширении арсенала технических средств в области применения биолюминесцентных систем и достигается за счет идентификации молекул субстратов биолюминесцентной реакции (люциферинов) червя Chaetopterus variopedatus, окисление которых сопровождается испусканием света. Указанные компоненты бюолюминесцентной системы червя Chaetopterus variopedatus являются перспективными для применения в качестве реагентов для множества анализов, включая диагностические системы, системы контроля качества, системы тестирования лекарственных препаратов и т.д.
[12]Указанный технический результат достигается посредством разработки и создания соединений общей формулы (I) или общей формулы (II):
[13]
[14]или его таутомер, стереоизомер или энантиомер, фармацевтически приемлемая соль, сольват или гидрат, где:
[15]n выбирается независимо и представляет собой 0-3;
[16]х выбирается независимо и представляет собой 1-5;
[17]m выбирается независимо и представляет собой 1-6;
[18]у выбирается независимо и представляет собой 0-7;
[19]R выбирается независимо и представляет собой -C1-10-алкил, замещенный или незамещенный моно, ди, три или тетрациклический C6-20-арил, необязательно содержащий гетероатом, выбранный из 0-3 атомов О, 0-6 атомов N, 0-3 атомов S, 0-2 атомов Si, где указанный моно, ди, три или тетрациклический C6-20-арил может быть замещен 1-6 заместителями, выбранными из галогена, -С=О, фенила, фенил-СООН.
[20]В частных вариантах воплощения, настоящее изобретение обеспечивает молекулу люциферина червя, а именно (10E,12Z)-9-гидропероксиоктадекадиеновую кислоту, характеризующуюся следующей структурной формулой:
[21]
[22]Настоящее изобретение также включает применение соединений общей формулы (I) или общей формулы (II) в качестве субстрата для фермента люциферазы (люциферина), окисление данной молекулы приводит к появлению света.
[23]Указанный технический результат достигается также посредством разработки и создания соединений общей формулы (III):
[24]Gly-Polyol-Acyl формула (III),
[25]или его таутомер, стереоизомер или энантиомер, фармацевтически приемлемая соль, сольват или гидрат, где
[26]Gly представляет собой углеводный фрагмент моносахарида,
[27]Polyol выбирается независимо и представляет собой многоатомный спирт;
[28]Acyl выбирается независимо и представляет собой гидропероксид полиненасыщенной жирной кислоты, который характеризуется следующей структурной формулой:
[29]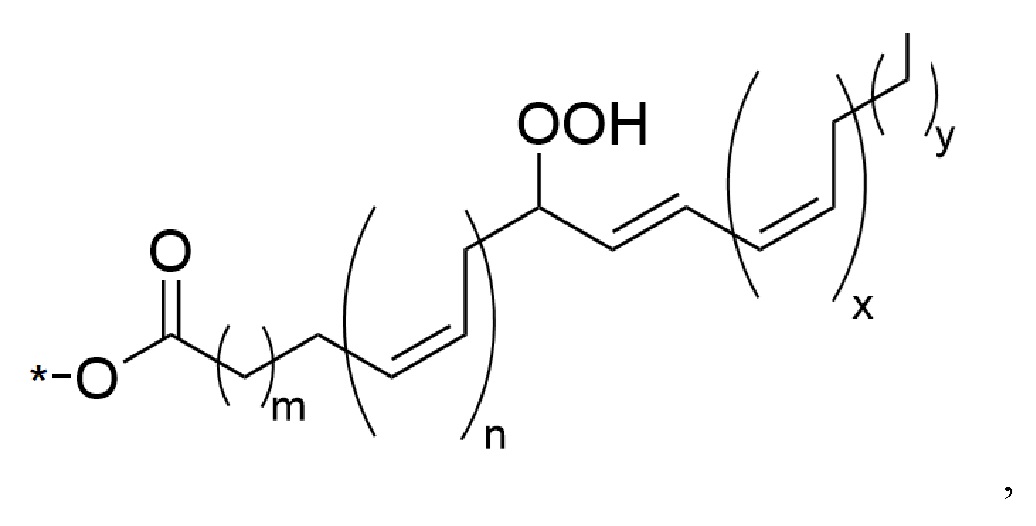
[30]где n выбирается независимо и представляет собой 0-3;
[31]х выбирается независимо и представляет собой 1-5;
[32]m выбирается независимо и представляет собой 1-6;
[33]у выбирается независимо и представляет собой 0-7.
[34]В частных вариантах воплощения изобретения многоатомный спирт выбирается независимо и представляет собой диол или триол.
[35]В частных вариантах воплощения изобретения углеводный фрагмент представляет собой альдопентозу, альдогексозу, кетопентозу или кетогексозу. В более конкретных вариантах воплощения изобретения углеводный фрагмент представляет собой рибозу, ксилозу, маннозу, галактозу, глюкозу, аллозу, рибулозу, ксилулозу, фруктозу или сорбозу.
[36]В частных вариантах воплощения, настоящее изобретение обеспечивает молекулу люциферина червя, а именно молекулу 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноат, также называемую 7-гидропероксид 2-глицерол-β-D-галактопиранозид (4Z,8E,10Z)-гексадекатриеноата, характеризующуюся следующей структурной формулой:
[37]
[38]и/или его региоизомер 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноат, также называемый 7-гидропероксид 3-глицерол-β-D-галактопиранозид (4Z,8E,10Z)-гексадекатриеноата, характеризующийся следующей структурной формулой:
[39]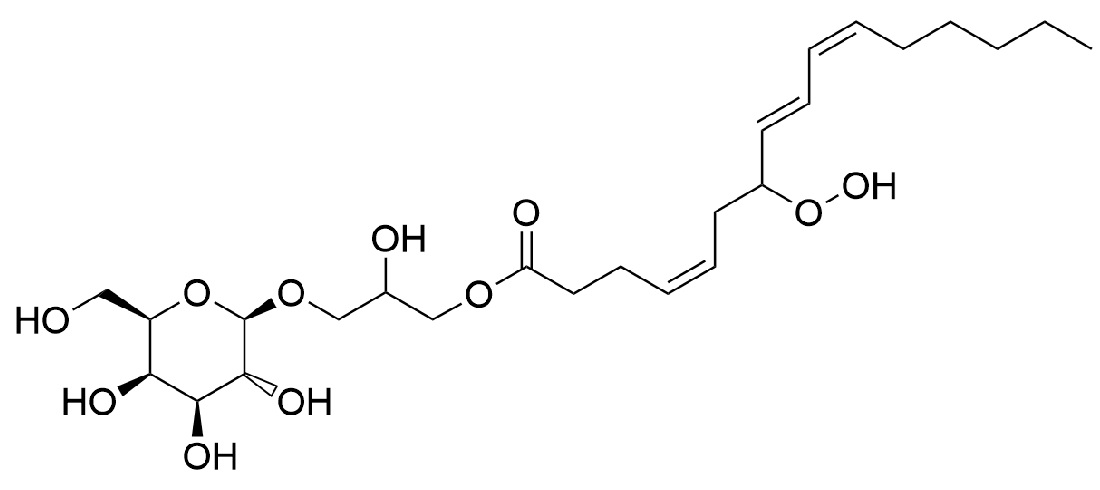 .
.
[40]Настоящее изобретение также включает применение соединений общей формулы (III) в качестве субстрата для фермента люциферазы (люциферина), окисление данной молекулы приводит к появлению света.
[41]Настоящее изобретение также включает соединение общей формулы (IV):
[42] формула (IV), или его таутомер, стереоизомер или энантиомер, фармацевтически приемлемая соль, сольват или гидрат, где:
формула (IV), или его таутомер, стереоизомер или энантиомер, фармацевтически приемлемая соль, сольват или гидрат, где:
[43]n выбирается независимо и представляет собой 2-8;
[44]х' выбирается независимо и представляет собой 1-7;
[45]m выбирается независимо и представляет собой 1-6.
[46]Настоящее изобретение также включает применение соединений общей формулы (IV) в качестве предшественника люциферина (предлюциферина).
[47]Настоящее изобретение также включает набор для детекции люциферазы в биологическом образце, включающий люциферин по изобретению.
[48]В частных вариантах воплощения изобретения набор дополнительно включает буфер, глицерин и соли железа (II).
[49]В частных вариантах воплощения изобретения указанные компоненты набора содержатся в допустимых количествах.
[50]Настоящее изобретение также включает биолюминесцентные композицию, включающую люциферазу и, по меньшей мере, одно соединение по настоящему изобретению. В частных вариантах воплощения изобретения люцифераза является рекомбинантной. В частных вариантах воплощения изобретения люцифераза представляет собой люциферазу червя Chaetopterus variopedatus.
[51]Кроме того, настоящее изобретение также обеспечивает способ выявления (детекции) люциферазы в биологическом образце, включающем люциферазу и/или липоксигеназу, и, по меньшей мере, одно соединение по изобретению. В частных вариантах воплощения изобретения люцифераза представляет собой люциферазу червя Chaetopterus variopedatus. В частных вариантах воплощения изобретения люцифераза представляет собой рекомбинантную люциферазу. В частных вариантах воплощения изобретения биологический образец представляет собой ткань и/или клетку. В частных вариантах воплощения изобретения биологический образец характеризуется значением рН в диапазоне от 7 до 8. В частных вариантах воплощения изобретения липоксигеназа представляет собой рекомбинантную липоксигеназу.
[52]В частных вариантах воплощения изобретения способ выявления люциферазы включает следующие этапы:
[53]а) добавление соединения по изобретению к биологическому образцу для получения реакционной смеси;
[54]б) инкубирование реакционной смеси в условиях, подходящих для возникновения биолюминесценции;
[55]в) детектирование биолюминесценции в реакционной смеси.
[56]В частных вариантах воплощения изобретения концентрация соединения по изобретению составляет 0.03 - 300 мкМ.
[57]Кроме того, обеспечивается способ детекции биолюминесценции в биологическом образце, включающем люциферазу и/или липоксигеназу, и, по меньше мере, одно соединение по изобретению. В частных вариантах воплощения изобретения люцифераза представляет собой рекомбинантную люциферазу. В частных вариантах воплощения изобретения люцифераза представляет собой люциферазу червя Chaetopterus variopedatus. В частных вариантах воплощения изобретения биологический образец представляет собой ткань и/или клетку. В частных вариантах воплощения изобретения биологически образец характеризуется значением рН в диапазоне от 7 до 8. В частных вариантах воплощения изобретения липоксигеназа представляет собой рекомбинантную липоксигеназу.
[58]В частных вариантах воплощения изобретения способ детекции биолюминесценции включает следующие этапы:
[59]а) экспрессию гена люциферазы в биологическом образце;
[60]б) добавление соединения по изобретению к биологическому образцу;
[61]в) детектирование биолюминесценции.
[62]В частных вариантах воплощения изобретения концентрация соединения по изобретению составляет 0.03 - 300 мкМ.
[63]Также настоящее изобретение обеспечивает реактивы и наборы реактивов для реализации методов настоящего изобретения.
[64]Настоящее изобретение также включает получение соединений по изобретению.
[65]Для более полного раскрытия вышеперечисленных характеристик настоящего изобретения ниже предлагается детальное описание изобретения, кратко сформулированного выше, в виде ссылок на воплощения, некоторые из которых проиллюстрированы дополнительными фигурами. При этом следует отметить, что прилагаемые фигуры иллюстрируют лишь типичные воплощения настоящего изобретения и, следовательно, не должны быть восприняты в качестве ограничения объема изобретения, которое может допускать другие, в равной степени эффективные, воплощения.
[66]Подробное раскрытие изобретения
[67]Краткое описание чертежей
[68]Фигура 1. Результат измерения биолюминесценции люциферина Chaetopterus variopedatus, инициированной впрыском двухвалентного железа во времени. Данные приведены в логарифмических единицах.
[69]Фигура 2. Гель-фильтрация образца люциферазы Chaetopterus на колонке Superdex 200.
[70]Фигура 3. Хроматография образца люциферина из водоросли C. linum на колонке С18. Стрелками указаны пики, проявляющие люминесцентную активность.
[71]Фигура 4. Структуры люминесцентно-активных соединений, выделенных из биомассы водоросли Chaetomorpha linum, установленные с использованием методов ЯМР-спектроскопии и ВЭЖХ-МС.
[72]Фигура 5. Зависимость интенсивности биолюминесценции от количества препарата люциферина.
[73]Фигура 6. Кинетика биолюминесцентной реакции (логарифмическая шкала) синтетического ((10E,12Z)-9-гидропероксиоктадека-10,12-диеновая кислота) и его функциональных аналогов, полученных окислением соевой липооксигеназой (LOX) или синглетным кислородом, генерируемым в присутствии метиленового голубого (1O2). 1 мкл люциферазной фракции 1 мг/мл +1 мкл 100 мкM FeSO4 + 1 мкл раствора субстрата в метаноле 0,3 мкM.
[74]Фигура 7. Кинетика биолюминесцентной реакции синтетических 9-,10-,12- и 13- гидропероксидов октадекадиеновой (линолевой) кислоты (1O2) и 9-,10-,12- и 13-гидропероксиды 1-оксопропил-β-D-галактопиранозид (9Z,12Z)-октадекадиеноата, полученных окислением синглетным кислородом, генерируемым в присутствии метиленового голубого. 1 мкл люциферазной фракции 1 мг/мл +1 мкл 100 мкM FeSO4 + 1 мкл раствора субстрата в метаноле 0,06 μM.
[75]Фигура 8. Кинетика биолюминесцентной реакции (логарифмическая шкала) синтетических 9-,10-,12- и 13- гидропероксидов октадекадиеновой (линолевой) кислоты (1O2) и гидропероксидов 2- и 3-глицерол-β-D-галактопиранозид-(9Z,12Z)-октадекадиеноата, полученных окислением синглетным кислородом, генерируемым в присутствии метиленового голубого. 1 мкл люциферазной фракции 1 мг/мл +1 мкл 100 мкM FeSO4 + 1 мкл раствора субстрата в метаноле 0,3 мкM.
[76]Фигура 9. Кинетика биолюминесцентной реакции (логарифмическая шкала) синтетических 9-,10-,12- и 13- гидропероксидов октадекадиеновой (линолевой) кислоты (1O2) и аналогов сопряженных с флуоресцентными красителями, полученных окислением синглетным кислородом, генерируемым в присутствии метиленового голубого (МГ). 1 мкл люциферазной фракции 1 мг/мл +1 мкл 100 мкM FeSO4 + 1 мкл раствора субстрата в метаноле 0,3 мкM.
[77]Определения и термины
[78]Различные термины, относящиеся к объектам настоящего изобретения, используются выше и также в описании и в формуле изобретения. Если иное не оговаривается, все технические и научные термины, используемые в данной заявке, имеют то же самое значение, которое понятно для специалистов в данной области. Ссылки на методики, используемые при описании данного изобретения, относятся к хорошо известным методам, включая изменения этих методов и замену их эквивалентными методами, известными специалистам.
[79]В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
[80]Термин «биолюминесценция» или «люминесценция» в настоящем документе означает процесс излучения света, получаемый в результате реакции между ферментом и субстратом, который генерирует свет.
[81]Термин «люциферин» в настоящем документе означает соединение, являющееся субстратом для ферментов люцифераз.
[82]Термин «функциональные аналоги» используется в настоящем изобретении для описания химических соединений, которые выполняют одну и ту же функцию и/или могут быть использованы для одного и того же назначения.
[83]Как здесь используется, термин «люцифераза» означает белок, который обладает способностью к окислению люциферина, где реакция окисления сопровождается выделением света (люминесценцией) и происходит освобождение окисленного люциферина.
[84]«Реакционная смесь люциферазы» содержит фермент люциферазу и материалы, которые позволят ферменту люциферазе генерировать световой сигнал. Необходимые материалы и конкретные концентрации и/или количества материалов, необходимых для генерации люминесцентного сигнала, варьируются в зависимости от используемого фермента люциферазы, а также от типа выполняемого анализа на основе люциферазы. Как правило, для люциферазы червя Chaetopterus variopedatus, эти материалы могут включать: буфер для поддержания реакции при правильном pH, фермент люцифераза червя Chaetopterus variopedatus, люциферин и соли железа (II). Часто к раствору могут добавляться другие материалы, в том числе: соли, в частности, хлорид натрия, ацетат натрия, цитрат натрия глицерин, аминокислоты и др. Типичная реакционная смесь люциферазы может содержать люциферазу червя Chaetopterus variopedatus, 50 мМ натрий-фосфатный буфер рН 7.4, 5% глицерин, 100 мкM FeSO4.
[85]«Смесь для обнаружения люциферазы» содержит материалы, которые позволят обнаружить фермент люциферазу. Необходимые материалы и конкретные концентрации и/или количества материалов, необходимых для генерации люминесцентного сигнала, будут варьируются в зависимости от используемого фермента люциферазы, а также от типа выполняемого анализа на основе люциферазы. В общем, для люциферазы червя Chaetopterus variopedatus эти материалы могут включать в себя: восстановители, детергенты, соли, глицерин, аминокислоты, субстрат люциферазы - люциферин. Часто к раствору могут добавляться другие материалы, в том числе: соли, глицерин, аминокислоты и т. д. Типичная смесь для обнаружения люциферазы может содержать субстрат люциферазы - люциферин червя Chaetopterus variopedatus согласно настоящему изобретению и/или его функциональный аналог, 50 мМ натрий-фосфатный буфер рН 7.4, 100 мкM FeSO4.
[86]Как здесь используется, термин «выделенный» означает молекулу или клетку, которые находятся в среде, отличной от среды, в которой молекула или клетка находятся в естественных условиях. Например, указанные компоненты могут находиться по существу в очищенной форме. По существу, очищенная форма означает, что белки являются, по меньшей мере, приблизительно на 20% чистыми, часто, по меньшей мере, на 30% чистыми, обычно на 50% чистыми, или, по меньшей мере, на 90% чистыми.
[87]Для выделения белков могут быть использованы любые обычные методики очистки белка, описанные, например, в Guide to Protein Purification, (Deuthser ed.) (Academic Press, 1990). Например, из исходного источника может быть приготовлен лизат или белковый препарат и очищен с использованием ВЭЖХ, эксклюзионной хроматографии, гель-электрофореза, аффинной хроматографии и т.п. Белковые препараты могут быть протестированы на наличие активной люциферазы или комплекса люциферазы и люциферина с помощью методов настоящего изобретения.
[88]Как здесь используется, термин "мутант" или "производное" относятся к белку (в частности, к люциферазе), раскрытому в настоящем изобретении, в котором одна или более аминокислот добавлены и/или замещены и/или удалены (делетированы) и/или вставлены (инсертированы) в N-конец и/или С-конец, и/или в пределах нативных аминокислотных последовательностей белков настоящего изобретения. Как здесь используется, термин "мутант" относится к молекуле нуклеиновой кислоты, которая кодирует мутантный белок. Кроме того, термин "мутант" здесь относится к любому варианту, который короче или длиннее белка или нуклеиновой кислоты.
[89]Модификации, а также добавки или делеции могут быть встроены любым методом, известным в данной области (см., например, Gustin et al., Biotechniques (1992) 14: 22; Barany, Gene (1985) 37: 11-123; и Colicelli et al., Mol. Gen. Genet. (1985) 199:537-539), Sambrook et al., Molecular Cloning: A Laboratory Manual, (1989), CSH Press, pp. 15.3-15.108), включая ошибочно-направленную ПЦР, перестановку, сайт-направленный мутагенез с использованием олигонуклеотидов, мутагенез с использованием ПЦР на основе спаренных молекул, мутагенез in vivo, кассетный мутагенез, рекурсивный согласованный мутагенез, экспоненциальный согласованный мутагенез, сайт-направленный мутагенез, случайный мутагенез, генную повторную сборку, генный сайт-насыщенный мутагенез (GSSM), повторную сборку при проведении синтеза лигированием (SLR), или их сочетание. Указанные модификации, добавления или делеции могут быть также встроены способом, включающим рекомбинацию, рекурсивную рекомбинацию последовательности, мутагенез ДНК путем фосфотиоатной модификации, мутагенез на основе включения матрицы, содержащей урацил, мутагенез на основе дуплекса, содержащего бреши, репарационный мутагенез с точечными ошибочными спариваниями, мутагенез с использованием штамма-хозяина, дефицитного по репарации, химический мутагенез, радиогенный мутагенез, делеционный мутагенез, мутагенез с использованием ограничения по селекции, мутагенез с использованием ограничения по очистке, искусственный синтез гена, согласованный мутагенез, создание химерного мультимера нуклеиновой кислоты или их сочетание.
[90]Как здесь используется, термин "функциональный" означает, что нуклеотидная или аминокислотная последовательность может функционировать для указанного испытания или задачи. Термин "функциональный", используемый для описания люцифераз, означает, что белок обладает способностью производить сопровождающуюся люминесценцией реакцию окисления люциферина.
[91]Термин «алкил» в настоящем документе означает как неразветвленные, так и разветвленные. Кроме того, «алкил» может быть как замещенным, так и незамещенным.
[92]Термин «алкил» в настоящем документе относится к группам, обычно имеющим от одного до десяти атомов углерода. Например, термин -C1-10-алкил означает метил, этил, изопропил, н-пропил.
[93]Термин «арил» в настоящем документе означает группы, содержащие ароматический цикл, имеющий от шести до двадцати атомов углерода, причем арил может представлять собой моно, ди, три или тетрацикл. В частных вариантах воплощения изобретения арил представляет собой замещенный или незамещенный моно, ди, три или тетрациклический C6-20-арил, необязательно содержащий гетероатом, выбранный из 0-3 атомов О, 0-6 атомов N, 0-3 атомов S,0 -2 атомов Si, где указанный моно, ди, три или тетрациклический C6-20-арил может быть замещен 1-6 заместителями, выбранными из галогена (в частности, хлор, бром, фтор), -С=О, фенила, фенил-СООН. Примером арильных групп могут быть:
[94]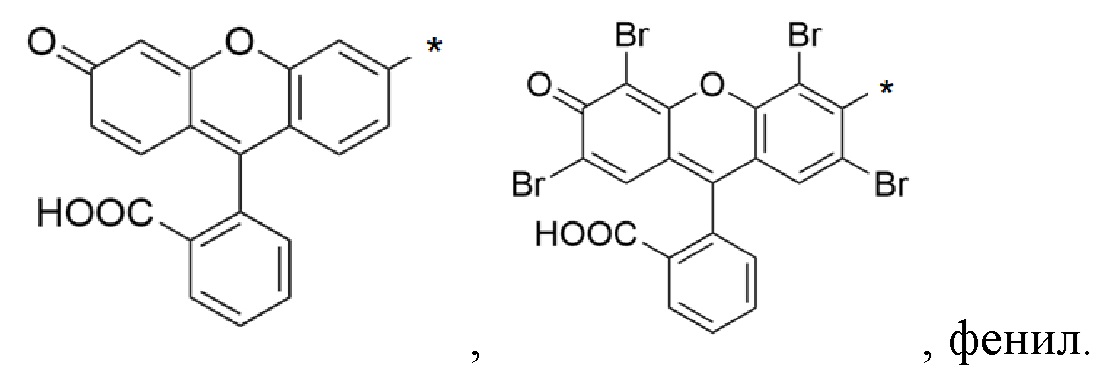
[95]Биологические образцы
[96]Реализация методов настоящего изобретения обеспечивает возникновение люминесценции реакционной смеси, содержащей биологический образец, если указанный образец содержит люциферазу, использующую в качестве субстрата люциферин согласно настоящему изобретению и/или его функциональные аналоги по изобретению. Такую люциферазу содержат, например, способные к биолюминесценции морские полихеты Chaetopterus variopedatus.
[97]Биологические образцы могут быть получены с помощью различных технологий, известных в биологии, и включают образцы тканей, клеток, экстракты, гомогенаты, белковые смеси различной степени очистки и т.д. Например, биологические образцы могут быть получены из морских полихет Chaetopterus variopedatus.
[98]Биологические образцы могут также содержать выделенные компоненты (люциферазу или люциферазу и люциферин согласно настоящему изобретению и/или функциональные аналоги) биолюминесцентных систем полихет Chaetopterus variopedatus.
[99]Биологические образцы могут также экспрессировать рекомбинантную люциферазу или её функциональные мутанты. Последовательности нуклеиновых кислот для экспрессии указанных белков могут быть получены из природных источников (например, из полихет Chaetopterus variopedatus) или синтезированы. В настоящее время известно множество методов для клонирования генов, кодирующих белки, обладающие известной активностью. Частично такие методы описаны в Maniatis, T., et al. (Molecular Cloning--A Laboratory Manual Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. 1982) и Newman и Campagnoni (Neuromethods, v. 16, 1990, pp 13-48). Например, может быть приготовлена экспрессионная библиотека в подходящих клетках-хозяевах и протестирована на активность люциферазы. Или может быть осуществлено выделение белка из белкового препарата, определена его частичная аминокислотная последовательность и осуществлено клонирование соответствующей кДНК из образца кДНК из полихет Chaetopterus variopedatus. Последовательности нуклеиновых кислот должны быть встроены в кассету экспрессии. Кассета экспрессии может существовать как внехромосомный элемент или может быть включена в геном клетки в результате введения указанной кассеты экспрессии в клетку. В кассете экспрессии нуклеиновая кислота, кодирующая белок, является функционально связанной с регуляторной последовательностью, которая может включить промоторы, энхансеры, терминаторы, операторы, репрессоры и индукторы. После введения кассеты экспрессии в клетку в ней может образовываться функциональный белок. Системы экспрессии включают, например, бактериальные системы, дрожжевые клетки, насекомых, рыб, земноводных или клетки млекопитающих. Методы изготовления кассет экспрессии или систем для экспрессии желаемого продукта известны специалистам, квалифицированным в данной области. Клеточные линии, которые устойчиво экспрессируют люциферазу могут быть выбраны способами, известными в данной области (например, ко-трансфекция с селектируемым маркером, таким как dhfr, gpt, неомицин, гигромицин, что делает возможным выявление и выделение трансфицированных клеток, которые содержат ген, включенный в геном). Вышеописанные системы экспрессии могут использоваться в прокариотических или эукариотических хозяевах. Для получения белка могут использоваться клетки-хозяева, такие как Е. coli, В. subtilis, S. cerevisiae, клетки насекомого в комбинации с бакуловирусными векторами, или клетки высшего организма, такого как позвоночные, например, COS 7 клетки, НЕК 293, СНО, ооциты Xenopus и т.д.
[100]Могут быть также экспрессированы функциональные мутанты природных белков. Как используется в настоящем описании, термин «функциональный» по отношению к люциферазе означает, что указанный белок способен использовать люциферины по изобретению, в частности (10E,12Z)-9-гидропероксиоктадекадиеновую кислоту, 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноат, также называемую 7-гидропероксид 2-глицерол-β-D-галактопиранозид (4Z,8E,10Z)-гексадекатриеноата, или 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноат, также называемый 7-гидропероксид 3-глицерол-β-D-галактопиранозид (4Z,8E,10Z)-гексадекатриеноата.
[101]Ссылка на нуклеотидную последовательность, "кодирующую" полипептид означает, что с нуклеотидной последовательности в ходе трансляции и транскрипции мРНК продуцируется этот полипептид. При этом может быть указана как кодирующая цепь, идентичная мРНК и обычно используемая в списке последовательностей, так и комплементарная цепь, которая используется как матрица при транскрипции. Как очевидно для любого специалиста в данной области техники, термин также включает любые вырожденные нуклеотидные последовательности, кодирующие одинаковую аминокислотную последовательность. Нуклеотидные последовательности, кодирующие полипептид, включают последовательности, содержащие интроны.
[102]Реактивы для выявления активности люциферазы
[103]Методы настоящего изобретения основаны на использовании люциферинов и/или функциональных аналогов по изобретению для детекции активности люциферазы в биологических образцах.
[104]Как используется в настоящем описании, (10E,12Z)-9-гидропероксиоктадекадиеновая кислота представляет собой соединение, имеющее следующую структурную формулу:
[105]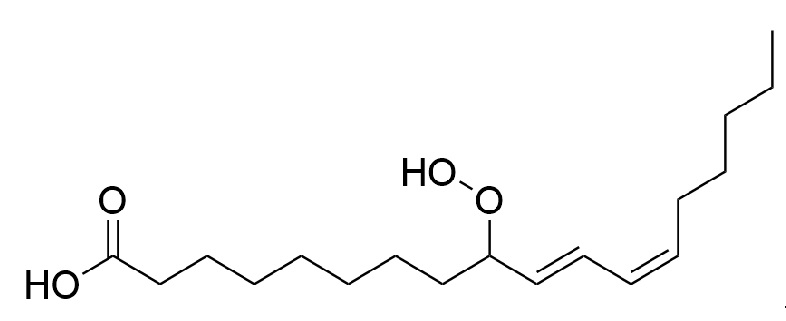
[106]Как используется в настоящем описании, люциферин 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноат, также называемый 7-гидропероксид 2-глицерол-β-D-галактопиранозид (4Z,8E,10Z)-гексадекатриеноата, имеющий следующую структурную формулу:
[107] .
.
[108]Как используется в настоящем описании, региоизомер вышеуказанного соединения 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноат, также называемый 7-гидропероксид 3-глицерол-β-D-галактопиранозид (4Z,8E,10Z)-гексадекатриеноата, имеющий следующую структурную формулу:
[109]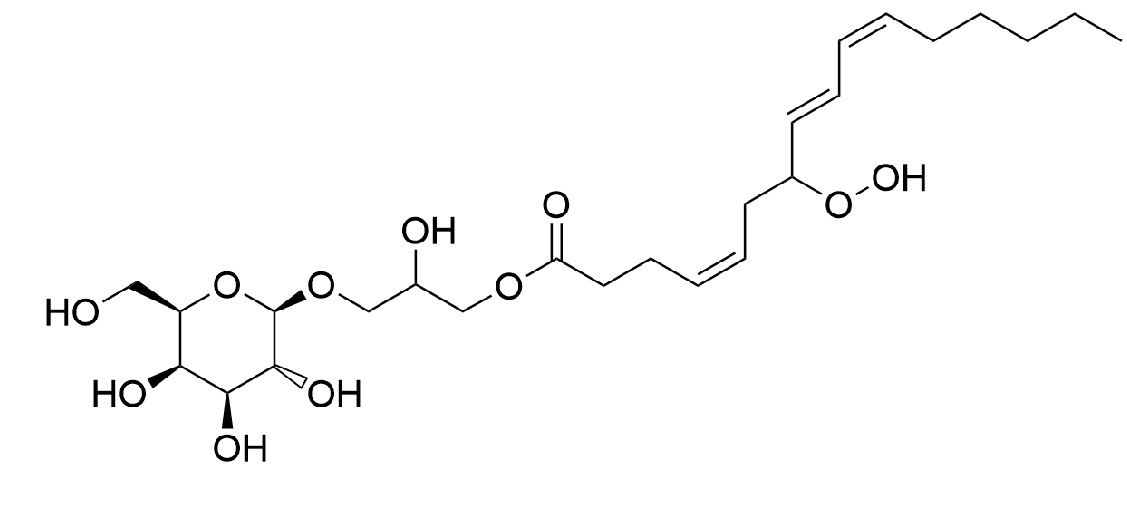 .
.
[110]Эти новые выделенные авторами настоящего изобретения люциферины имеют уникальное строение, отличающее их от всех ранее описанных природных люциферинов. Так, основу молекулы люциферина червя Chaetopterus составляет пероксид полиненасыщенной жирной кислоты (ПНЖК) или пероксид полиненасыщенной жирной кислоты (ПНЖК) конденсированный с глицерил гликозидом. Такие структуры ранее не встречались в качестве субстратов биолюминесцентных реакций. Лиофильно высушенный субстрат хранится при -20°С без снижения активности не менее 30 дней, чаще не менее 60 дней, обычно не менее года.
[111]Авторами настоящего изобретения разработан путь синтеза неприродных полиненасыщенных жирных кислот на примере (4Z,7Z,10Z)-гексадека-4,7,10-триеновой кислоты - структурного фрагмента люциферина червя Chaetopterus variopedatus 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноат (схема 1). Рекомендованная схема синтеза указанного соединения включает 10 стадий и использует гептин-1 в качестве исходного вещества. Её достоинствами являются: мягкие условия проведения реакций на стадиях кросс-сочетания благодаря катализу солями меди и высокие выходы при получении соответствующих пропаргилбромидов в реакции Аппеля. Последующие конденсация (4Z,7Z,10Z)-гексадека-4,7,10-триеновой кислоты 8 с глицерил тетраацетилгликозидом, удаление ацетильных защитных групп и пероксидирование синглетным кислородом в присутствии метиленового голубого приводят к целевому продукту - люциферину червя Chaetopterus variopedatus.
[112]
[113]Схема 1. Синтез люциферина червя Chaetopterus - 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата и его региоизомера 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата.
[114]Состав условий для развития биолюминесцентного сигнала
[115]Формирование биолюминесценции зависит от количества и сохранности люциферазы в биологических образцах. Так же следует отметить воздействие светового излучения, особенно УФ части спектра, на люциферин, приводящее к его деградации и утрате функциональности.
[116]На формирование сигнала влияет рН реакционной смеси. Формирование биолюминесцентного сигнала происходит в диапазоне рН от 6.0 до 9.8, обычно в диапазоне рН от 6.5 до 9.0, преимущественно, в диапазоне от 7.0 до 8.0. Для обеспечения рН могут быть использованы любые стандартные буферные растворы для данного диапазона рН, включая фосфатный буфер, HEPES, Трис-HCl. В преимущественных воплощениях молярность буферного раствора не превышает 2, например, не превышает 1, чаще находится в диапазоне от 0.05 до 0.4, обычно от 0.1 до 0.2.
[117]Реакционные смеси для нужд настоящего изобретения могут также содержать ингибиторы протеаз, например, фенилуксусную кислоту или щавелевую кислоту в стандартно используемых концентрациях.
[118]Для нужд настоящего изобретения люциферин согласно настоящему изобретению и/или его функциональные аналоги по изобретению добавляют к биологическому образцу до конечной концентрации 0.03-300 мкМ, чаще 1-5 мкМ.
[119]В некоторых вариантах воплощения изобретения к образцу добавляют смесь реагентов, включающих буферный раствор, компоненты, стабилизирующие и защищающие ферменты биолюминесцентной системы от деградации протеазами и раствор FeSO4. В других воплощениях к биологическому образцу сперва добавляют буферный раствор, компоненты, защищающие ферменты от деградации протеазами, а затем раствор люциферина согласно настоящему изобретению и/или его функциональных аналогов и раствор FeSO4.
[120]В зависимости от растворителя, использованного для приготовления раствора люциферина согласно настоящему изобретению и/или его функциональных аналогов, реакционная смесь может содержать небольшие количества использованных растворителей.
[121]Развитие биолюминесцентного сигнала происходит в широком диапазоне температур - от 4 до 40°С, оптимально при 20-25°С.
[122]Формирование люминесцентного сигнала начинается сразу после инициации реакции при добавлении ключевых реактивов для выявления активности люциферазы, указанных выше.
[123]Максимальная интенсивность люминесценции наблюдается в момент инициации реакции. Далее идет спад, скорость которого определяется активностью ферментов и начальными концентрациями субстратов. При определенных условиях (субстратов много, активность ферментов мала, температура реакции снижена) реакция может наблюдаться в течение 30 и более минут (фигура 1).
[124]Детекция биолюминесценции
[125]Методы настоящего изобретения включают детекцию биолюминесценции, возникающей в биологическом образце, содержащем люциферазу, при появлении в нем люциферина.
[126]Биолюминесценция может быть обнаружена с помощью методов, известных специалистам в данной области, в частности, с помощью визуального скрининга или с использованием люминометра, фотометра, флуориметра, цифровой фотокамеры, с помощью светочувствительной фотопленки. В качестве количественной характеристики может быть использована максимальная интенсивность люминесценции, которая достигается через 1-5 сек после инициации биолюминесцентной реакции или скорость нарастания люминесценции в интервале до 30 мин после инициации биолюминесцентной реакции, например, в течение 1, 5, 10, 20, 30, 60 сек после инициации реакции или дольше.
[127]В преимущественных воплощениях измеряемая люминесценция представляет собой, световые вспышки скорее, чем длительное свечение. В преимущественных воплощениях интенсивность люминесценции зависит от активности ферментов биолюминесцентной системы, присутствующих в образце, начальных концентраций субстратов и температуры реакционной смеси и обычно колеблется в пределах от 10 кв/сек до 10 млн кв/сек, чаще 100 - 100000 кв/сек.
[128]Реакция длится не менее 5 мин после инициации, чаще 10-15 мин, иногда (в зависимости от условий) 30 и более минут.
[129]Испускаемый при окислении люциферина согласно настоящему изобретению и/или его функциональных аналогов свет находится в диапазоне от 440 до 510 нм, чаще в диапазоне от 450 до 475 нм, с максимумом эмиссии при 455-461 нм.
[131]Методы и реактивы настоящего изобретения могут быть использованы в широком спектре биолюминесцентных анализов in vivo и in vitro.
[132]В частности, методы и реактивы настоящего изобретения могут быть использованы для выявления активных компонентов биолюминесцентных системы полихет Chaetopterus variopedatus в процессе их очистки.
[133]Также методы и реактивы настоящего изобретения могут быть использованы для выявления функциональных аналогов ферментов биолюминесцентной системы полихет Chaetopterus variopedatus в биологических образцах.
[134]Также методы и реактивы настоящего изобретения могут быть использованы для выявления активности рекомбинантной люциферазы в клетках-хозяевах.
[135]В некоторых вариантах воплощения изобретения для осуществления применения должна быть получена нуклеиновая кислота, кодирующая люциферазу. Полученная нуклеиновая кислота должна быть встроена в кассету экспрессии, обеспечивающую временную или постоянную экспрессию этой нуклеиновой кислоты в клетках-хозяевах, например под интересующими исследователя промоторами. Кассета экспрессии может содержать элементы, обеспечивающие адресную доставку конструкции в интересующие клетки или клеточные компартменты, или находится в составе частиц, обеспечивающих адресную доставку. После трансфекции клеток кассетой экспрессии (например, в составе экспрессионного вектора) и по истечении времени, необходимого для наработки в клетках продукта экспрессии, может быть осуществлено выявление активности люциферазы внутри клеток или в клеточном лизате.
[137]Также обеспечиваются в соответствии с настоящим изобретением наборы для использования при осуществлении вышеописанных применений.
[138]В некоторых воплощениях наборы обычно включают люциферин согласно настоящему изобретению и/или его функциональный аналог, предпочтительно с буферным раствором для растворения указанного субстрата и/или его добавления к биологическим образцам. Люциферин согласно настоящему изобретению и/или его функциональный аналог могут присутствовать в растворенном виде в соответствующей среде для хранения, такой как водный или буферный раствор, обычно в соответствующей емкости. Альтернативно, люциферин согласно настоящему изобретению и/или его функциональный аналог могут присутствовать в наборе в лиофилизованном виде.
[139]В дополнение к описанным выше компонентам, заявленные наборы могут дополнительно включать инструкции для осуществления заявленных способов. Эти инструкции могут присутствовать в заявленных наборах в различных формах (например, в печатном варианте или на электронном носителе в виде текстового и/или графического файла) в количестве одна или более.
[140]Биолюминисцентные композиции
[141]Также обеспечиваются в соответствии с настоящим изобретением биолюминисцентные композиции для использования при осуществлении вышеописанных применений.
[142]В некоторых воплощениях композиции обычно включают люциферин согласно настоящему изобретению и/или его функциональный аналог, предпочтительно с буферным раствором для растворения указанного субстрата и/или его добавления к биологическим образцам. Люциферин согласно настоящему изобретению и/или его функциональный аналог могут присутствовать в растворенном виде в соответствующей среде для хранения, такой как водный или буферный раствор. Альтернативно, люциферин согласно настоящему изобретению и/или его функциональный аналог могут присутствовать в композиции в лиофилизованном виде.
[143]В дополнение к описанным выше компонентам, заявленные композиции могут дополнительно включать вспомогательные вещества, в частности, адъюванты, растворители и/или наполнители, такие, которые совместимы с соединениями, составляющими суть данного изобретения, и которые не разрушают биологической активности этих соединений.
[144]Следующие примеры предлагаются в качестве иллюстративных, но не ограничивающих.
[146]Получение образцов нативной люциферазы
[147]Образцы люциферазы для измерения люминесцентной активности и экспериментов по конверсии in vitro были получены согласно следующей процедуре.
[148]Очищенные образцы люциферазы C. variopedatus были получены в результате последовательной очистки водного экстракта замороженных червей: 100 г замороженной биомассы C. variopedatus гомогенизировали в 300 мл 10 мМ фосфатного буфера с рН 7.5, затем подвергали ультразвуковой обработке и центрифугированию (25000 g х 20 мин) при 4°С на центрифуге Avanti® J-E (Beck-man Coulter, USA). Супернатант ступенчато насыщали сульфатом аммония до концентрации 30%, а затем 60%, с повторным центрифугированием в тех же условиях после каждой стадии. Итоговый осадок разводили в 35 мл 10 мМ фосфатного буфера с рН 6, и диализовали 1 ч при 4°С. Полученный образец центрифугировали 25000 g х 20 мин при 4°С, супернатант пропускали через колонку 30 х 100 мм с Cellulose DEAE-32 (Serva), уравновешенную 10 мМ фосфатным буфером с рН 6. К итоговым 100 мл образца добавляли 500 мкл 2 М фосфатного буфера с рН 9 и наносили на колонку 16 х 200 мм с Sepharose DEAE FF (GE Sweden), уравновешенную 10 мМ фосфатным буфером с рН 7.5. После промывки колонки 10 мМ фосфатным буфером с рН 7.5, проводили элюцию линейным градиентом 160 мл того же буфера, но с 0.5 М NaCl, со скоростью 4 мл/мин. Итоговые активные фракции объединяли, добавили к ним сульфат аммония до концентрации 60%, затем центрифугировали 25000 g х 20 мин при 4°С. Полученный осадок разводили в 10 мл 10 мМ фосфатного буфера с рН 7.5 и наносили на колонку 30 х 1000 мм с Sephacryl S-200, уравновешенную 100 мМ фосфатным буфером с рН 7.5. Элюцию проводили со скоростью 1.5 мл/мин. Активные фракции объединяли, разводили водой до конечной концентрации буфера 25 мМ и наносили со скоростью 2 мл/мин на колонку 10 х 500 мм с Sepharose DEAE FF, уравновешенную 10 мМ фосфатного буфера с рН 7.5. После промывки колонки элюцию образцов проводили линейным градиентом 300 мл 0.5 М NaCl в фосфатном буфере, со скоростью 4 мл/мин. Активные фракции объединяли и концентрировали до объёма 200 мкл на центрифужных фильтрах 30 кДа Ultracel-30 (Amicon, Ireland), после чего наносили со скоростью 0.5 мл/мин на колонку Superdex 200, уравновешенную 100 мМ фосфатным буфером (рН 7.5). Результат этой хроматографии показан на фигуре 2.
[149]Экстракция, разделение и очистка субстратов люциферазы Chaetopterus
[150]Получение препарата люциферина
[151]Люциферин экстрагировали из 10г замороженной биомассы C. variopedatus 20 мл 70% этанола в течение 1 часа при 0°С, после чего центрифугировали 25000 g х 20 мин при 4°С. Полученный супернатант разводили равным объёмом дистиллированной воды и наносили на концентрирующий патрон С16М (Биохиммак, Москва). После промывки 50% этанолом, образец элюировали 2 мл 96% этанола и доводили его объём до 100 мкл на вакуумном концентраторе «Eppendorf 5301». Полученный препарат люциферина далее использовали в качестве субстрата в проводимых реакциях.
[152]Методика выделения субстрата (аналога) C. variopedatus из водоросли Chaetomorpha linum
[153]Извлекали из аквариума 10 г водоросли C. linum, промывали в дистиллированной воде от остатков морской воды. Гомогенизировали в 100 мл дистиллированной воды с помощью механического гомогенизатора. К гомогенату добавляли этилового спирта до 60% конечной концентрации. Центрифугировали 25000g х 20мин на центрифуге Avanti® J-E (Beck-man Coulter, USA). Осадок отбросили, супернатант развели в 2 раза 10 мМ фосфатным буфером рН 9.0. Получившийся экстракт пропустили через колонку 30х100 мм, содержащую сорбент Cellulose DEAE 32 (хроматограф BioLogic Duo-Flow). Фильтрат нанесли на колонку 20х100 мм, содержащую сорбент Диасорб-60-С16Т (Биохиммак, Москва). Колонку промывали раствором 50% этанола-вода. Искомое вещество элюировали с сорбента 96% этанолом в условиях изократики. Активные пробы были объединены, всего получилось 10 мл. Получившийся образец высушили на испарителе и развели в 400 мкл 96% этанола и очищали с помощью обращенно-фазовой ВЭЖХ. Использовали полупрепаративную колонку (9,4 х 250 мм), ZORBAX Eclipse XDB-C18 (Agilent Technologies), соединенную с хроматографом Agilent 1260 Infinity LC. Элюирование проводили с использованием программы градиентного элюирования: растворитель A представлял собой 0,1% муравьиную кислоту, а растворитель B представлял собой ацетонитрил. Стандартная градиентная программа составляла 5-40% B в течение 25 мин. И колонку, и растворители поддерживали при комнатной температуре со скоростью потока 3 мл/мин. Поглощение контролировали при 210, 230, 250, 270, 290, 310, 330 и 360 нм. Фракции проявляющие активность, соответствующие пикам 1-3, собирали отдельно (Фигура 3). В результате были получены 3 активных пика. Пики рехроматографировали по отдельности на той же колонке. Полученные активные фракции пиков высушили на роторном испарителе Eppendorf concentrator 5301 при комнатной температуре и развели в 100 мкл 96% этанола. После чего, провели гельфильтрационную хроматографию, этих практически гомогенных веществ, на колонке Superdex Peptide 10/300 GL в смеси 0,1% муравьиной кислоты и 50% ацетонитрила. Фракции, содержащие активность, объединили и высушили на роторном испарителе.
[154]ЯМР-спектроскопия и масс-спектрометрия
[156]Структуры субстратов биолюминесцентной реакции Chaetopterus variopedatus (люциферинов) (10E,12Z)-9-гидропероксиоктадекадиеновой кислоты, 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата и его региоизомера 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата подтверждены совокупностью данных ЯМР-спектроскопии (см. табл. 1-3).
[157]Для определения структуры люминесцентных соединений, полученных из водоросли Chaetomorpha linum, был использован традиционный подход, основанный на ЯМР, включающий анализ 1D1H и13C, 2D DQF-COSY, 2D1H-13C HSQC и 2D1H-13C HMBC и 2D1H-13C HSQC -TOCSY спектров, зарегистрированных в ДМСО-d6. В первую очередь была определена структура соединения peak #3 (фигура 4). Это соединение характеризовалось массой молекулярного иона [M-H]-, равной 311.222, и дополнительным пиком в МС с m/z 293.212. Согласно ЯМР-спектрам (10E,12Z)-9-гидропероксиоктадекадиеновая кислота (таблица 1) представляет собой линейную молекулу, содержащую карбоксильную группу (13С 174.89 м.д. и уширенный протонный синглет при 12 м.д.), две двойные связи и гидропероксидную группу (синглетный протон при 11.27 м.д. и третичный углерод при 85.08 м.д.). Структура peak #3 (фигура 4) соответствует (10E, 12Z)-9-гидропероксиоктадека-10,12-диеновой кислоте. Конфигурация двойных связей была определена на основе значений констант спин-спинового взаимодействия (КССВ), которые были равны 15 Гц для связи 10-11 и 11 Гц для связи 12-13. Структура идеально соответствует массе молекулярного иона 311.222, дополнительный мажорный пик 293.212 в масс-спектре - это продукт восстановления пероксида с карбонильной группой в положении 9.
[158]Таблица 1. Химические сдвиги и данные ЯМР для (10E,12Z)-9-гидропероксиоктадекадиеновой кислоты
[159]| № атома | 13C | 1H | мультиплетность | HMBC/TOCSY |
| 1 | 174.89 | - | | |
| 1-OH | - | 11.92 | br.a | - |
| 2 | 34.16 | 2.18 | t(7)c | 1,3,4/3b |
| 3 | 24.95 | 1.49 | p(7) | 1,2,4,5/2,4 |
| 4 | 28.97 | 1.26 | ov. | - |
| 5 | 29.13 | 1.26 | ov. | - |
| 6 | 29.32 | 1.26 | ov. | - |
| 7 | 25.20 | 1.26 | ov. | - |
| 8 | 32.78 | 1.39;1.59 | m/m | 6,7,9,10/7,9 |
| 9 | 85.08 | 4.24 | q(7) | 7,8,10,11/8,10 |
| 9-OOH | - | 11.28 | s | - |
| 10 | 133.71 | 5.60 | dd(15,7) | 8,12/9,11 |
| 11 | 127.97 | 6.47 | dd(15,11) | 9,12,13/10,12 |
| 12 | 128.61 | 5.99 | dd(11,11) | 10,11,14/11,13 |
| 13 | 132.66 | 5.44 | dt(11,7) | 11/12,14 |
| 14 | 27.51 | 2.15 | q(7) | 12,13,15,16/13,15 |
| 15 | 29.17 | 1.35 | p(7) | 13,14,16,17/14,16 |
| 16 | 31.24 | 1.26 | ov. | - |
| 17 | 22.43 | 1.28 | ov. | - |
| 18 | 14.39 | 0.87 | t(7) | 16,17/17 |
aov. - перекрывающиеся сигналы, br. - уширенный сигнал
bкорреляции между соответствующими сигналами водородов и углеродов в 2D спектрах HMBC/HSQC-TOCSY (время смешивания=10 мс)
смультиплетности сигналов (s - синглет, d - дублет, t - триплет, q - квадруплет, p - квинтет, m - мультиплет) |
[160]Для соединений peak #1 и peak #2 (фигура 4) (1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноат и 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата соответственно) наблюдались практически идентичные паттерны фрагментации в масс-спектрах высокого разрешения с основными пиками при m/z 483.263, 501.269 и 536.314 в режиме регистрации положительных ионов. Анализ спектров ЯМР показал, что оба соединения содержат три идентичных остатка с различными типами сочленения: гексапиранозу, глицерин и модифицированную полиненасыщенную жирную кислоту. В peak #1 жирная кислота связана со вторым углеродом глицерина, в то время как для peak #2 глицерин замещен в положениях 1 и 3. Анализ гексапиранозного фрагмента позволил однозначно установить его как β-галактозу на основе химических сдвигов13C (с использованием программного обеспечения CASPER (Lundborg M., Widmalm G., Methods Mol Biol. 2015, 1273, 29-40.) и величин констант спин спинового взаимодействия в спектрах1Н. КССВ H1-H2 равна 7 Гц, что предполагает β-конфигурацию аномерного углерода; и небольшая КССВ (менее 2 Гц) наблюдается между протонами H4 и H5, что подразумевает галактозную конфигурацию гексапиранозы. В отличие от peak #3, жирная кислота peak #1 и peak #2 насчитывала 16 атомов углерода и содержала 3 двойные связи в положениях 4 (Z), 8 (E) и 10 (Z), с гидропероксидной группой в положении 7 ((4Z, 8E, 10Z)-7-гидропероксигексадека-4,8,10-триеновая кислота). Согласно данным ЯМР, расчетная молекулярная масса соединения равна 518.27, что не соответствует ни одному из пиков наблюдаемых в спектре ВЭЖХ-МС, однако молекулярный ион [M+H]+ с m/z = 501.296 соответствует M-H2O+H+, m/z 483.26 соответствует M-2*H2O+H+, тогда как m/z 536.31 может соответствовать М+NH4+. Можно предположить, что гидропероксиды peak #1 и peak #2 не выдерживают ионизацию протонами и превращаются в кетоны. Структуры соединений peak #1 и peak #2 и химические сдвиги ЯМР показаны на фигуре 4 и в таблицах 2 и 3.
[161]Таблица 2. Химические сдвиги и данные ЯМР 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата
[162]| № атома | 13C | 1H | мультиплетность | HMBC/TOCSY |
| 1 | 172.56 | - | | |
| 2 | 33.96 | 2.36 | dt(3,7)a | 1,3,4/3b |
| 3 | 22.94 | 2.26 | ov.c | 1,2,4,5/2,4 |
| 4 | 130.26 | 5.44 | ov. | 3,6/3,5 |
| 5 | 126.19 | 5.37 | m(11 - 5,DR)d | 3,6/4,6 |
| 6 | 30.93 | 2.27;2.42 | ov./ov. | 4,5,7,8/5,7 |
| 7 | 84.64 | 4.29 | q(7) | 5,6,8,9/6,8 |
| 7-OOH | - | 11.40 | s | - |
| 8 | 132.73 | 5.61 | dd(15,7) | 6,7,10/7,9 |
| 9 | 128.37 | 6.49 | dd(15,11) | 7,10,11/8,10 |
| 10 | 128.49 | 5.98 | dd(11,11) | 8,9,12/9,11 |
| 11 | 133.03 | 5.46 | ov. | 9,12/10,12 |
| 12 | 27.55 | 2.17 | q(7) | 10,11,13,14/11,13 |
| 13 | 29.17 | 1.37 | p(7) | 11,12,14,15/12,14 |
| 14 | 31.27 | 1.28 | ov. | |
| 15 | 22.40 | 1.30 | ov. | |
| 16 | 14.39 | 0.87 | t(7) | 14,15/15 |
| 1' | 67.57 | 3.61;3.79 | dd(6,11)/dd(6,11) | 1'',2',3'/2' |
| 2' | 74.01 | 4.89 | p(7) | 1',3'/1',3' |
| 3' | 60.30 | 3.57;3.63 | ov. | 1,1',2'/2' |
| 3'-OH | | 4.78 | br. | -/3' |
| 1'' | 104.25 | 4.09 | d(7) | 1',2'',3''/2'' |
| 2'' | 70.93 | 3.29 | ov. | -/1'',3'' |
| 2''-OH | | 4.79 | br. | -/2'' |
| 3'' | 73.88 | 3.28 | ov. | -/2'',4'' |
| 3''-OH | | 4.70 | br. | -/3'' |
| 4'' | 68.60 | 3.64 | m. | 3''/3'' |
| 4''-OH | | 4.34 | d(4) | 3'',4'',5''/4'' |
| 5'' | 75.81 | 3.34 | ov. | 3'',4'',6'',1''/6'' |
| 6'' | 60.85 | 3.49;3.51 | ov. | -/5'' |
| 6''-OH | | 4.53 | br. | -/6'' |
aмультиплетности сигналов (s - синглет, d - дублет, t - триплет, q - квадруплет, p - квинтет, m - мультиплет)
bкорреляции между соответствующими сигналами водородов и углеродов в 2D спектрах HMBC/HSQC-TOCSY (время смешивания=10 мс)
cov. - перекрывающиеся сигналы, br. - уширенный сигнал
dDR - КССВ замеренный в эксперименте двойного резонанса |
[163]Таблица 3. Химические сдвиги и данные ЯМР для 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата
[164]| № атома | 13C | 1H | мультиплетность | HMBC/TOCSY |
| 1 | 172.84 | - | | |
| 2 | 33.79 | 2.36 | dt(3,7)a | 1,3,4/3b |
| 3 | 22.94 | 2.26 | ov.c | 1,2,4,5/2,4 |
| 4 | 130.26 | 5.42 | ov. | 3,6/3,5 |
| 5 | 126.19 | 5.37 | m(11 to 5,DR)d | 3,6/4,6 |
| 6 | 30.93 | 2.27;2.42 | ov./ov. | 4,5,7,8/5,7 |
| 7 | 84.64 | 4.30 | q(7) | 5,6,8,9/6,8 |
| 7-OOH | - | 11.40 | s | - |
| 8 | 132.73 | 5.61 | dd(15,7) | 6,7,10/7,9 |
| 9 | 128.37 | 6.49 | dd(15,11) | 7,10,11/8,10 |
| 10 | 128.49 | 5.98 | dd(11,11) | 8,9,12/9,11 |
| 11 | 133.03 | 5.46 | ov. | 9,12/10,12 |
| 12 | 27.55 | 2.17 | q(7) | 10,11,13,14/11,13 |
| 13 | 29.17 | 1.37 | p(7) | 11,12,14,15/12,14 |
| 14 | 31.27 | 1.28 | ov. | |
| 15 | 22.40 | 1.30 | ov. | |
| 16 | 14.39 | 0.87 | t(7) | 14,15/15 |
| 1' | 70.88 | 3.44;3.70 | ov. | 1'',2',3'/2' |
| 2' | 67.88 | 3.85 | m | 1',3'/1',3' |
| 2'-OH | | 4.97 | d(5.5) | 1',2',3'/2' |
| 3' | 66.09 | 3.99;4.07 | dd(7,11)/ov. | 1,1',2'/2' |
| 1'' | 104.25 | 4.09 | d(7) | 1',2'',3''/2'' |
| 2'' | 71.01 | 3.29 | ov. | -/1'',3'' |
| 2''-OH | | 4.85 | d(4) | 1'',2'',3''/2'' |
| 3'' | 73.75 | 3.28 | ov. | -/2'',4'' |
| 3''-OH | | 4.69 | d(4.5) | 2'',3'',4''/3'' |
| 4'' | 68.60 | 3.64 | m. | 3''/3'' |
| 4''-OH | | 4.36 | d(4) | 3'',4'',5''/4'' |
| 5'' | 75.81 | 3.34 | ov. | 3'',4'',6'',1''/6'' |
| 6'' | 60.88 | 3.48;3.53 | ov. | -/5'' |
| 6''-OH | | 4.56 | d(4.5) | 5'',6''/6'' |
aмультиплетности сигналов (s - синглет, d - дублет, t - триплет, q - квадруплет, p - квинтет, m - мультиплет)
bкорреляции между соответствующими сигналами водородов и углеродов в 2D спектрах HMBC/HSQC-TOCSY (время смешивания=10 мс)
cov. - перекрывающиеся сигналы, br. - уширенный сигнал
dDR - КССВ замеренный в эксперименте двойного резонанса |
[165]Общая методика получения пероксидов ПНЖК с помощью липоксигеназLOX
[166]К 10 мл боратного буфера (pH=9) добавляли ПНЖК (0,3 ммоль), перемешивали полчаса для получения однородной эмульсии. Смесь охлаждали до 0°С и добавляли 5 мг соевой липоксигеназы LOX-1 (Sigma Aldrich, type-IB, ≥ 50000 units/mg). Продували кислород через получившуюся смесь, поддерживая температуру в пределах от 0°С до 5°С в ходе реакции. За полнотой протекания реакции следили по ТСХ (CHCl3:IPA 20:1). Реакционную смесь разбавляли 30 мл насыщенного раствора NH4Cl и экстрагировали эфиром (3 x 15 мл). Органическую фазу сушили над безводным Na2SO4, растворитель упаривали. Продукт выделяли с помощью флеш-хроматографии на картридже PF50SIHC-F0012, (Гексан:iPrOH=95:5).
[167]Общая методика получения пероксидов ПНЖК окислением синглетным кислородом в присутствии метиленового голубого
[168]Для получения пероксидов методом фотоокисления, ПНЖК и их производные (0,1 ммоль) растворяли в 1 мл метанола и помещали полученный раствор в ампулу. Добавляли раствор 0.1 мг/мл метиленового голубого (0.13 ммоль) в метаноле. Лампу (Nova II, 150 Ватт) помещали на расстоянии 15-20 см перед ампулой и пробулькивали кислород через реакционную смесь в течение 4-6 ч, до тех пор, пока ТСХ не демонстрировало полного превращения исходных ПНЖК и их производных в более полярные продукты. Затем реакционную смесь упаривали, растворяли в 3 мл дихлорметана и промывали водой (2 х 1 мл) и насыщенным раствором NaCl (1 х 1 мл). ДХМ упаривали, полученную смесь очищали с помощью препаративной ОФ-ВЭЖХ (элюент А - вода, элюент B - ацетонитрил, скорость потока 5 мл/мин, линейный градиент от 30-100% В за 25 мин). Фракции, содержащие целевое вещество, лиофилизировали и анализировали с помощью ОФ-ВЭЖХ.
[169]Использование (10E,12Z)-9-гидропероксиоктадека-10,12-диеновой кислоты для выявления люциферазы в биологических образцах
[170]Люциферин ((10E,12Z)-9-гидропероксиоктадека-10,12-диеновая кислота) был получен, как описано выше в разделе «Экстракция, разделение и очистка субстратов люциферазы Chaetopterus». В качестве образцов использовали хроматографически очищенный на колонкe Superdex 200 белковый препарат из биомассы червя Chaetopterus variopedatus. Данный препарат был получены как описано выше в разделе «Получение частично очищенной люциферазы».
[171]1 мкл 0,3 мкM раствора субстрата (10E,12Z)-9-гидропероксиоктадека-10,12-диеновая кислота в метаноле, 1 мкл 100 мкM FeSO4.
[172]В ходе эксперимента в каждом случае сначала измеряли фоновую люминесценцию люциферазной фракции, затем добавляли аликвоты раствора (10E,12Z)-9-гидропероксиоктадека-10,12-диеновой кислоты. Биолюминесцентную реакцию инициировали впрыском в измерительную кювету 1 мкл 100 мкM раствора сульфата железа (Fe2+). Во всех случаях была выявлена люминесценция биологических образцов.
[173]Измерение зависимости интенсивности биолюминесценции от количества субстрата
[174]Для измерения зависимости интенсивности свечения от количества препарата люциферина в реакционную смесь, содержащую 200 мкл 0.2 М фосфатного буфера с рН 7.5 и 5 мкл хроматографически очищенной люциферазы, вносили 0,5 мкл препарата люциферина ((10E,12Z)-9-гидропероксиоктадека-10,12-диеновой кислоты), предварительно разводя его в метаноле для получения разной концентрации. Биолюминесцентную реакцию инициировали впрыском в измерительную кювету 10 мкл 25 мкМ раствора сульфата железа (Fe2+). Полученная зависимость близка к линейной: при варьировании количества люциферина интенсивность биолюминесценции меняется более чем в 100 раз (Фигура 5).
[175]Использование (10E,12Z)-9-гидропероксиоктадека-10,12-диеновой кислоты для детекции биолюминесценции в биологических образцах
[176]Люциферин ((10E,12Z)-9-гидропероксиоктадека-10,12-диеновая кислота) был получен, как описано выше в разделе «Экстракция, разделение и очистка субстратов люциферазы Chaetopterus». В качестве биологических образцов использовали осветленные лизаты тканей Chaetopterus variopedatus. Лизаты тканей были получены как описано выше в разделе «Получение частично очищенной люциферазы».
[177]1 мкл 0,3 мкM раствора субстрата (10E,12Z)-9-гидропероксиоктадека-10,12-диеновая кислота в метаноле, 1 мкл 100 мкM FeSO4.
[178]В ходе эксперимента в каждом случае сначала измеряли фоновую люминесценцию лизата, затем добавляли аликвоты раствора (10E,12Z)-9-гидропероксиоктадека-10,12-диеновой кислоты. Биолюминесцентную реакцию инициировали впрыском в измерительную кювету 1 мкл 100 мкM раствора сульфата железа (Fe2+). Во всех случаях была выявлена люминесценция биологических образцов.
[179]Использование 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата и/или 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата для детекции биолюминесценции в биологических образцах
[180]Люциферин 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата и/или 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата был получен, как описано выше в разделе «Порядок экстракции предлюциферина». В качестве биологических образцов использовали осветленные лизаты тканей Chaetopterus variopedatus. Лизаты тканей были получены как описано выше в разделе «Получение частично очищенной люциферазы»
[181]1 мкл 0,3 мкM раствора субстрата 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата и/или 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата в метаноле, 1 мкл 100 мкM FeSO4.
[182]В ходе эксперимента в каждом случае сначала измеряли фоновую люминесценцию лизата, затем добавляли аликвоты раствора 1-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропан-2-ил(4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата и/или 2-гидрокси-3-(((2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)пропил (4Z,8E,10Z)-7-гидропероксигексадека-4,8,10-триеноата. Биолюминесцентную реакцию инициировали впрыском в измерительную кювету 1 мкл 100 мкM раствора сульфата железа (Fe2+). Во всех случаях была выявлена люминесценция биологических образцов.
[183]Использование гидропероксидов полиненасыщенных жирных кислот для выявления люциферазы в биологических образцах
[184]Гидропероксиды полиненасыщенных жирных кислот были получены, как описано выше в разделах «Общая методика получения пероксидов ПНЖК с помощью липоксигеназLOX» и «Общая методика получения пероксидов ПНЖК окислением синглетным кислородом в присутствии метиленового голубого». В качестве образцов использовали хроматографически очищенный на колонкe Superdex 200 белковый препарат из биомассы червя Chaetopterus variopedatus. Данный препарат был получены как описано выше в разделе «Получение частично очищенной люциферазы».
[185]1 мкл 0,3 мкM раствора субстрата гидропероксида ПНЖК в метаноле, 1 мкл 100 мкM FeSO4
[186]В ходе эксперимента в каждом случае сначала измеряли фоновую люминесценцию люциферазной фракции, затем добавляли аликвоты раствора функционального аналога люциферина. Биолюминесцентную реакцию инициировали впрыском в измерительную кювету 1 мкл 100 мкM раствора сульфата железа (Fe2+). Во всех случаях была выявлена люминесценция биологических образцов. (Фигура 6)
[187]В качестве модельных субстратов использовали: пероксиды линолевой кислоты.
[188]LOX: 9-гидропероксид (10E,12Z)-октадекадиеновой (линолевой) кислоты.
[189]Синглетный кислород (1O2): 9-,10-,12- и 13-гидропероксиды октадекадиеновой (линолевой) кислоты,
[190]и пероксиды линоленовой кислоты.
[191]LOX: 9- и 13-гидропероксиды октадекатриеновой (линоленовой) кислоты.
[192]Синглетный кислород (1O2): 9-,10-,12-, 13-, 15- и 16-гидропероксиды октадекатриеновой (линоленовой) кислоты.
[193]Использование гидропероксидов гликолипидов, содержащих диольный линкер для выявления люциферазы в биологических образцах
[194]Гидропероксиды гликолипидов были получены, как описано выше в разделе «Общая методика получения пероксидов ПНЖК окислением синглетным кислородом в присутствии метиленового голубого». В качестве биологических образцов использовали хроматографически очищенный на колонкe Superdex 200 белковый препарат из биомассы червя Chaetopterus variopedatus. Данный препарат был получены как описано выше в разделе «Получение частично очищенной люциферазы».
[195]1 мкл 0,06 мкM раствора субстрата гидропероксида гликолипида в метаноле, 1 мкл 100 мкM FeSO4
[196]В ходе эксперимента в каждом случае сначала измеряли фоновую люминесценцию люциферазной фракции, затем добавляли аликвоты раствора функционального аналога люциферина. Биолюминесцентную реакцию инициировали впрыском в измерительную кювету 1 мкл 100 мкM раствора сульфата железа (Fe2+). Во всех случаях была выявлена люминесценция биологических образцов. (Фигура 7)
[197]В качестве модельных субстратов использовали смесь 9-,10-,12- и 13-гидропероксидов 1-оксопропил-β-D-галактопиранозид (9Z,12Z)-октадекадиеноата:
[198]Использование гидропероксидов гликолипидов, содержащих триольный линкер для выявления люциферазы в биологических образцах
[199]Гидропероксиды гликолипидов были получены, как описано выше в разделе «Общая методика получения пероксидов ПНЖК окислением синглетным кислородом в присутствии метиленового голубого». В качестве биологических образцов использовали хроматографически очищенный на колонкe Superdex 200 белковый препарат из биомассы червя Chaetopterus variopedatus. Данный препарат был получены как описано выше в разделе «Получение частично очищенной люциферазы».
[200]1 мкл 0,3 мкM раствора субстрата гидропероксида гликолипида в метаноле, 1 мкл 100 мкM FeSO4
[201]В ходе эксперимента в каждом случае сначала измеряли фоновую люминесценцию люциферазной фракции, затем добавляли аликвоты раствора функционального аналога люциферина. Биолюминесцентную реакцию инициировали впрыском в измерительную кювету 1 мкл 100 мкM раствора сульфата железа (Fe2+). Во всех случаях была выявлена люминесценция биологических образцов. (Фигура 8)
[202]В качестве модельных субстратов использовали смесь 9-,10-,12- и 13-гидропероксидов 2- и 3-глицерол-β-D-галактопиранозид-(9Z,12Z)-октадекадиеноата
[203]Использование гидропероксидов ПНЖК сопряженных с флуоресцентными красителями для выявления люциферазы в биологических образцах
[204]Гидропероксиды ПНЖК сопряженных с флуоресцентными красителями были получены, как описано выше в разделе «Общая методика получения пероксидов ПНЖК окислением синглетным кислородом в присутствии метиленового голубого». В качестве биологических образцов использовали хроматографически очищенный на колонкe Superdex 200 белковый препарат из биомассы червя Chaetopterus variopedatus. Данный препарат был получены как описано выше в разделе «Получение частично очищенной люциферазы».
[205]1 мкл 0,3 мкM раствора субстрата гидропероксида гликолипида в метаноле, 1 мкл 100 мкM FeSO4
[206]В ходе эксперимента в каждом случае сначала измеряли фоновую люминесценцию люциферазной фракции, затем добавляли аликвоты раствора функционального аналога люциферина. Биолюминесцентную реакцию инициировали впрыском в измерительную кювету 1 мкл 100 мкM раствора сульфата железа (Fe2+). Во всех случаях была выявлена люминесценция биологических образцов. (Фигура 9).
[207]В качестве модельных субстратов использовали смесь 9-,10-,12- и 13-гидропероксидов линолевой кислоты, сопряженной с флуоресцеином (9,10,12,13-гидропероксиды 2-(6-(((9Z,12Z)-октадека-9,12-диеноил)окси)-3-оксо-3H-ксантен-9-ил) бензойной кислоты) и смесь 9-,10-,12- и 13-гидропероксидов линолевой кислоты, сопряженной с эозином (9,10,12,13-гидропероксиды 2-(2,4,5,7-тетрабромо-6-(((9Z,12Z)-9-гидропероксиоктадека-9,12-диеноил)окси)-3-оксо-3H-ксантен-9-ил) бензойной кислоты).
[208]Использование полиненасыщенных жирных кислот для выявления люциферазы в биологических образцах
[209]В качестве биологических образцов использовали хроматографически очищенный на колонкe Superdex 200 белковый препарат из биомассы червя Chaetopterus variopedatus. Данный препарат был получены как описано выше в разделе «Получение частично очищенной люциферазы».
[210]1 мкл 1 мM раствора субстрата линолевой кислоты в метаноле, 1 мкл соевой липоксигеназы LOX-1 (Sigma Aldrich, type-IB, ≥ 50 000 units/mg) в фосфатном буфере pH 7.4. В ходе эксперимента описанную реакционную смесь инкубировали при комнатной температуре в течение 30 минут. Затем добавляли 1 мкл люциферазной фракции 1 мг/мл, биолюминесцентную реакцию инициировали впрыском в измерительную кювету 1 мкл 100 мкM раствора сульфата железа (Fe2+). Во всех случаях была выявлена люминесценция биологических образцов.
[211]Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.


 , где n выбирается независимо и представляет собой 0-3; х выбирается независимо и представляет собой 1; m выбирается независимо и представляет собой 1-6; у выбирается независимо и представляет собой 3. Технический результат изобретения заключается в расширении арсенала технических средств в области применения биолюминесцентных систем за счет идентификации молекул субстратов биолюминесцентной реакции (люциферинов) червя Chaetopterus variopedatus, окисление которых сопровождается испусканием света. 2 н. и 17 з.п. ф-лы, 9 ил., 3 табл.
, где n выбирается независимо и представляет собой 0-3; х выбирается независимо и представляет собой 1; m выбирается независимо и представляет собой 1-6; у выбирается независимо и представляет собой 3. Технический результат изобретения заключается в расширении арсенала технических средств в области применения биолюминесцентных систем за счет идентификации молекул субстратов биолюминесцентной реакции (люциферинов) червя Chaetopterus variopedatus, окисление которых сопровождается испусканием света. 2 н. и 17 з.п. ф-лы, 9 ил., 3 табл.









 .
. формула (IV), или его таутомер, стереоизомер или энантиомер, фармацевтически приемлемая соль, сольват или гидрат, где:
формула (IV), или его таутомер, стереоизомер или энантиомер, фармацевтически приемлемая соль, сольват или гидрат, где:

 .
. .
.

