[1]Настоящее изобретение относится к области техники генной инженерии, в частности, к генной инженерии клеток Bacillus для получения сиалированных олигосахаридов в указанных клетках Bacillus, к ферментативной продукции сиалированных олигосахаридов с использованием указанных клеток Bacillus и к применению полученных таким образом сиалированных олигосахаридов.
[2]Предшествующий уровень техники
[3]Человеческое грудное молоко обеспечивает детей грудного возраста всеми питательными веществами, в которых они нуждаются для здорового роста и развития. Сахариды, которые присутствуют в человеческом грудном молоке, представляют собой его основной компонент, превосходя жиры и белки. Помимо лактозы, которая служит источником энергии, человеческое грудное молоко содержит молекулы более сложных сахаридов, а именно, олигосахаридов. На сегодняшний день в человеческом грудном молоке идентифицировано приблизительно 200 структурно отличающихся олигосахаридов. Данные олигосахариды обнаружены в значимых концентрациях только в человеческом молоке, и они суммарно известны как олигосахариды грудного молока (ОГМ). Указанные ОГМ основаны на дисахариде - лактозе (состоящей из группировки глюкозы (Glc) и группировки галактозы (Gal)) и несут дополнительные остатки моносахаридов, которые основаны на N-ацетил-глюкозамине (GlcNAc), фукозе (Fuc), сиаловой кислоте/N-ацетилнейраминовой кислоте (NeuNAc) и/или галактозе (Gal). Концентрация и состав ОГМ в человеческом грудном молоке варьирует среди индивидуумов и на протяжении периода лактации от вплоть до 20 г/л в молозиве до 5-10 г/л в зрелом молоке.
[4]Значимое число ОГМ несет одну группировку NeuNAc. Среди данных сиалированных олигосахаридов грудного молока (СОГМ), 3'-сиалиллактоза, 6'-сиалиллактоза, сиалиллакто-N-тетраоза а, сиалиллакто-N-тетраоза b, сиалиллакто-N-тетраоза с и дисиалиллакто-N-тетраоза представляют собой наиболее распространенные члены в человеческом грудном молоке.
[5]Сиаловые кислоты (Sia) представляют собой семейство отрицательно заряженных моносахаридов с каркасом из девяти атомов углерода. Более чем 50 форм данных α-кетокислот обнаружено в природе. Наиболее распространенной сиаловой кислотой, по-видимому, является N-ацетилнейраминовая кислота (NANA -от англ. N-acetylneuraminic acid, NeuNAc, Neu5Ac).
[6]Сиаловые кислоты находятся в качестве концевых моносахаридных группировок гликанов, которые находятся в гликоконъюгатах (гликопротеины и гликолипиды) на поверхности клеток позвоночных и высших беспозвоночных. Сиаловые кислоты являются компонентами липополисахаридов и капсульных полисахаридов патогенных бактерий, включая Escherichia coli K1, Haemophilus influenzae, Haemophilus ducreyi, Pateurella multocida, Neisseria gonorrhoeae, Neisseria meningitidis, Campylobacter jejuni и Streptococcus agalactiae.
[7]Наблюдали, что сиалированные ОГМ поддерживают устойчивость грудного ребенка к энтеропатогенным бактериям и вирусам. Что интересно, недавние исследования, кроме того, продемонстрировали защитное действие длинноцепочечных СОГМ в отношении некротического энтероколита, который является одним из наиболее распространенных и смертельных заболеваний у недоношенных новорожденных. Кроме того, показано, что сиалированные олигосахариды нейтрализуют энтеротоксины разных патогенных микробов, включая Escherichia coli, Vibrio cholerae и Salmonella. Кроме того, обнаружено, что сиалированные олигосахариды препятствуют колонизации кишечника Helicobacter pylori и, вследствие этого, предотвращают или ингибируют язвы желудка и двенадцатиперстной кишки. Кроме того, полагают, что сиалированные олигосахаирды поддерживают развитие головного мозга младенца и его когнитивные способности.
[8]Благодаря известной пользе от ОГМ, главным образом сиалированных ОГМ, экономически целесообразный способ их получения является желательным, таким образом, чтобы данные сиалированные олигосахариды или по меньшей мере некоторые из данных сиалированных олигосахаридов стали доступными в качестве добавки к детским питательным смесям.
[9]Ограниченная доступность грудного молока для целей, отличных от грудного вскармливания грудного ребенка, и сложности получения чистых фракций отдельных олигосахаридов грудного молока из природных источников привели к разработке химических путей их синтеза. Однако, и химический синтез, и биокаталитические подходы in-vitro оказались коммерчески нерациональными. Кроме того, в частности химический синтез олигосахаридов грудного молока включает применение нескольких вредных химических веществ, которые накладывают риск загрязнения конечного продукта.
[10]В качестве альтернативы химическому и биокаталитическому синтезу in-vitro разработано ферментативное получение ОГМ. На сегодняшний день, рекомбинантные клетки Escherichia coli используют для микробной продукции некоторых ОГМ в промышленном масштабе.
[11]Однако, род Escherichia coli включает патогенные члены, а также непатогенные члены. Несмотря на то, что для микробной продукции ОГМ используют непатогенные штаммы Е. coli, такие непатогенные Е. coli не считают безопасными для изготовления продуктов, которые предназначены для потребления человеком во множестве областей. Это мешает одобрению контролирующими органами ОГМ, изготавливаемых современными биотехнологическими способами, для потребления человеком в указанных областях. Таким образом, микробные клетки родов, которые расценивались бы как безопасные для потребления человеком или расценивались бы как безопасные при использовании в получении соединений для потребления человеком в таких областях, необходимы для изготовления сахаридов, которые предназначены для потребления человеком, например, олигосахаридов грудного молока, в частности, для потребления грудными детьми. Применение продуктивных штаммов, считающихся безопасными, уменьшает, по меньшей мере предположительно, проблемы в отношении вероятности рисков для здоровья человека, обусловленных сахаридом, и будет облегчать их одобрение контролирующими органами в большинстве областей.
[12]Проблема решается посредством использования бактериальных клеток рода Bacillus для получения сиалированных олигосахаридов, в частности сиалированных ОГМ. Бактериальные клетки некоторых видов рода Bacillus уже расцениваются как безопасные для потребления человеком или для получения соединений/пищи для потребления человеком. Следовательно, предложены клетки Bacillus вида и/или штаммов, которые обычно расцениваются как безопасные для получения сиалированных олигосахаридов, в частности, для получения сиалированных олигосахаридов грудного молока.
[13]Бактерии рода Bacillus являются грамположительными, палочковидными, образующими эндоспоры микробными клетками или аэробных, или факультативно анаэробных видов. Род Bacillus принадлежит к типу Фирмикуты. Геном членов рода Bacillus имеет тенденцию к парам оснований А-Т в своей частоте использования кодона. Виды Bacillus почти повсеместно распространены в природе. Например, они могут быть найдены в почве (В. subtilis), а также встречаются в экстремальных условиях окружающей среды, таких как высокий рН (В. alcalophilus), высокая температура (В. thermophilus) или высокое содержание солей (В, halodurans).
[14]Род Bacillus включает 266 видов, имеющих название, которые включают свободноживущие виды, а также паразитарные патогенные виды. Два вида Bacillus считаются значимыми с медицинской точки зрения: В. anthracis, который вызывает сибирскую язву, и В. cereus, который вызывает пищевое отравление. Третий вид, В. thuringiensis, является важным патогеном насекомых, продуцирующим токсин, который может уничтожать насекомых. Таким образом, он используется в качестве инсектицида для борьбы с насекомыми-вредителями.
[15]Из-за их статуса GRAS (от англ. generally recognized as safe - общепризнан безопасным), несколько видов Bacillus, например, В. amyloliquefaciens, В. licheniformis и B. subtilis, используются в биотехнологическом получении разных белков и соединений, используемых в пищевой и фармацевтической промышленности.
[16]Bacillus amyloliquefaciens является источником рестриктазы BamHI и также синтезирует природный белок - антибиотик барназу. Кроме того, В. amyloliquefaciens продуцирует плантазолицин, антибиотик с селективной активностью в отношении В.anthracis. Альфа-амилаза из В. amyloliquefaciens часто используется в гидролизе крахмала. В. amyloliquefaciens также является источником субтилизина, который катализирует распад белков.
[17]Bacillus amyloliquefaciens представляет собой бактерию-колонизатора корней, которая используется для того, чтобы бороться с некоторыми патогенами корней растений в сельском хозяйстве, водной культуре и гидропонике, поскольку она оказывает действие против бактериальных и грибковых патогенов и может предотвращать инфицирование в результате конкурентного исключения или вытеснения нежелательного патогена в конкурентной борьбе.
[18]Ее высокая способность секретировать щелочную сериновую протеазу сделала B. licheniformis одной из наиболее важных бактерий в промышленном производстве фермента. Субтилизин Carlsberg, секретируемый В. licheniformis, используют в качестве протеазы для моющих средств, и он продается под торговым названием Alcalase®.
[19]Bacillus subtilis представляет собой бактерию, позитивную в отношении каталазы, которая обнаружена в почве и желудочно-кишечном тракте жвачных животных и человека. В. subtilis и вещества, происходящие из данной бактерии, не содержащей эндотоксин, оценивались разными авторитетными органами в отношении их безопасности и пользы в применении в пищевой продукции. В Соединенных Штатах ферменты карбогидраза и протеаза из В. subtilis общепризнаны безопасными (GRAS) Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA - от англ. Food and Drug Administration). Bacillus subtilis также присвоен статус «квалифицированной презумпции безопасности» Европейским агентством по безопасности продуктов питания.
[20]Кроме того, нетоксигенные и непатогенные штаммы В. subtilis обычно используются в пищевой промышленности. Например, ферментированные соевые бобы в виде натто часто потребляют в Японии, и они содержат вплоть до 108 жизнеспособных клеток В. subtilis на грамм. Натто признают за их вклад в здоровую флору кишечника и поглощение витамина K2. Продукт натто и В. subtilis var. natto в качестве его основного компонента представляют собой FOSHU (от англ. Foods for Specified Health Use - пищевые продукты, специально используемые для поддержания здоровья), одобренные министерством здравоохранения, труда и социальной защиты Японии как эффективные для сохранения здоровья.
[21]С В. subtilis легко работать, она быстро растет, и условия культивирования являются простыми. Рекомбинантные штаммы В. subtilis используют в продукции полигидроксиалканолатов, гиалуроновой кислоты и разных ферментов, таких как амилаза и протеазы.
[22]С природными изолятами В. subtilis дикого типа сложно работать, по сравнению с лабораторными штаммами, которые подвергались процессам одомашнивания на основе мутагенеза и селекции. Данные одомашненные штаммы часто обладают улучшенными способностями к развитию природной компетентности (поглощению и интеграции ДНК окружающей среды), улучшенными способностями к росту и потере способностей, необходимых «в дикой природе». В В. subtilis линейная ДНК, а также мультимерные формы плазмидной ДНК активно поглощаются природными компетентными клетками.
[23]В определенных физиологических условиях маленькая субпопуляция клеток В. subtilis становится компетентной. В В. subtilis природная компетентность регулируется сложной регуляторной сетью. Ключевые регуляторы в данной сети представляют собой, среди прочих, мастер регулятор компетентности СоmK и транскрипционный мастер регулятор споруляции SpoOA. Эффективность трансформации клеток В. subtilis и возможно эффективность интеграции ДНК в их геном можно улучшать посредством генной инженерии. Это может быть достигнуто посредством эктопической интеграции экспрессионной кассеты, содержащей регулируемый промотор (например, промотор, индуцируемый маннитом  ) и гены comK и comS, в геном В. subtilis. Дополнительно, данная стратегия обеспечивает трансформацию В. subtilis за счет природной компетентности с использованием сложной среды (например, LB).
) и гены comK и comS, в геном В. subtilis. Дополнительно, данная стратегия обеспечивает трансформацию В. subtilis за счет природной компетентности с использованием сложной среды (например, LB).
[24]Для продукции сиалированных олигосахаридов клетки Bacillus можно генетически конструировать разными способами.
[25]Термин «генетически сконструированный», в том виде, в котором он используется в данном документе, относится к модификации генетического состава клетки Bacillus с использованием методов молекулярной биологии. Модификация генетического состава клетки Bacillus может включать перенос генов в пределах и/или через видовые связи, вставку, удаление, замену и/или модификацию нуклеотидов, триплетов, генов, открытых рамок считывания, промоторов, энхансеров, терминаторов и других нуклеотидных последовательностей, опосредуя и/или контролируя экспрессию генов. Модификация генетического состава клетки Bacillus нацелена на создание генетически сконструированной клетки, обладающей конкретными, желательными свойствами. Генетически сконструированные клетки Bacillus могут содержать один или более генов, которые отсутствуют в нативной (не генетически сконструированной) форме клетки. Методики введения экзогенных молекул нуклеиновой кислоты и/или осуществления вставки экзогенных молекул нуклеиновой кислоты (рекомбинантных, гетерологичных) в наследуемую информацию клетки Bacillus для вставки, удаления или изменения нуклеотидной последовательности генетической информации клетки известны квалифицированному специалисту. Генетически сконструированные клетки Bacillus могут содержать один или более генов, которые находятся в нативной форме клетки, где указанные гены модифицированы и повторно введены в клетку Bacillus искусственными средствами. Термин «генетически сконструированный» также охватывает клетки Bacillus, которые содержат молекулу нуклеиновой кислоты, являющуюся эндогенной в отношении клетки, и которая модифицирована без удаления молекулы нуклеиновой кислоты из клетки. Такие модификации включают модификации, полученные в результате замены генов, сайт-специфичных мутаций, и родственные методики.
[26]Интеграция гена и/или (одновременная) инактивация гена посредством нарушения или удаления может быть достигнута посредством гомологичной рекомбинации. Для эффективной гомологичной рекомбинации по меньшей мере 400-500 п. н. гомологичных плечей необходимы в В. subtilis.
[27]Еще одним способом направленного конструирования генома является система CRISPR-Cas9. Данный быстрый и безмаркерный инструмент редактирования генома может быть использован для крупномасштабных геномных делеций, маленьких и больших вставок ДНК, сайленсинга генов посредством введения стоп-кодона, а также введения точечных мутаций. Никаких предварительных модификаций генома не требуется для «бесшовного» редактирования генома посредством CRISPR-Cas9.
[28]Случайную хромосомную интеграцию генов и инсерционный мутагенез можно проводить, используя модифицированный транспозон mariner. Данная система не проявляет тенденцию к горячим точкам в В. subtilis, одновременно демонстрируя высокую эффективность в случайной эктопической интеграции.
[29]Несмотря на то, что виды Bacillus используют для промышленного производства ферментов, на сегодняшний день клетки Bacillus не внедрялись для промышленного производства олигосахаридов, в частности промышленного производства сиалированных олигосахаридов.
[30]В китайской патентной заявке CN 108410787 А раскрыты рекомбинантные клетки Bacillus subtilis, которые синтезируют лактил-N-неотетраозу. Указанные рекомбинантные клетки В. subtilis имеют ген лактозопермеазы, который интегрируют в геном клетки. Кроме того, указанная клетка Bacillus, которая несет плазмиду, содержащую ген β-1,3-N-глюкозаминтрансферазы и ген β-1,4-галактозилтрансферазы. Клетки В. subtilis можно культивировать в присутствии экзогенной лактозы и они синтезируют лактил-N-неотетраозу при титрах вплоть до примерно 1 г/л, что слишком мало для экономически целесообразного промышленного производства.
[31]В китайской патентной заявке CN 109735479 А раскрыты рекомбинантные клетки Bacillus subtilis для осуществления синтеза 2'-фукозиллактозы, где уровень экспрессии фермента-транспортера лактозы повышен, и где клетка экспрессирует фукозокиназу, фосфатгуанинтрансферазу и фукозилтрансферазу. Сообщалось, что выход 2'-фукозиллактозы в ферментационной среде составлял от 0,424 г/л до 1,042 г/л.
[32]Несмотря на то, что во множестве патентных заявок упоминается Bacillus в качестве рода, который, как считается, подходит для продукции нейтральных олигосахаридов, таких как лакто-N-неотетраоза или 2'-фукозиллактоза, никакого применения Bacillus для продукций сиалированных олигосахаридов, в частности сиалированных олигосахаридов грудного молока, еще не было реализовано, предположительно из-за значительных усилий в модификации метаболизма, которые требуются для реализации необходимых путей биосинтеза для продукции ОГМ в Bacillus. Тогда как указанная выше В. subtilis для продукции LNnT зависит от субстратов-доноров, которые встречаются в природе в клетках В. subtilis, продукция сиалированного олигосахарида в Bacillus требует реализации гетерологичного метаболического пути в клетке для обеспечения субстрата-донора, а именно СМР (от англ. Cytidine Monophosphatase - цитидинмонофосфат)-NeuNAc, который является крайне важным для синтеза сиалированных олигосахаридов.
[33]Цель была достигнута посредством предоставления клетки Bacillus, в которой имеется лактозопермеаза для импортирования экзогенной лактозы в клетку, путь биосинтеза CMP-NeuNAc для внутриклеточного образования нуклеотид-активируемой сиаловой кислоты, а именно, цитидинмонофосфат-N-ацетилнейраминовой кислоты (CMP-NeuNAc), в качестве субстрата-донора для группировки сиаловой кислоты, и сиалилтрансфераза для переноса группировки сиаловой кислоты с CMP-NeuNAc на субстрат-акцептор. Культивация таких клеток Bacillus в присутствии экзогенной лактозы делает возможной продукцию желательного сиалированного олигосахарида.
[34]Краткое изложение сущности изобретения
[35]Согласно первому аспекту предложена неспорообразующая бактериальная клетка рода Bacillus для получения сиалированного олигосахарида, где в клетке Bacillus имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза.
[36]Согласно второму аспекту предложено применение неспорообразующей бактериальной клетки рода Bacillus согласно первому аспекту для получения сиалированного олигосахарида.
[37]Согласно третьему аспекту предложен способ получения сиалированного олигосахарида, включающий:
[38]- предоставление неспорообразующей бактериальной клетки рода Bacillus, где в указанной клетке Bacillus имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза;
[39]- культивирование клетки Bacillus в культуральной среде, содержащей лактозу, и в условиях, которые являются пермиссивными в отношении клетки Bacillus, с продукцией сиалированного олигосахарида, и
[40]- возможно, извлечение сиалированного олигосахарида из культуральной среды и/или клетки Bacillus.
[41]Согласно четвертому аспекту предложены сиалированные олигосахариды, которые были продуцированы клеткой Bacillus, в которой имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза.
[42]Согласно пятому аспекту предложено применение сиалированного олигосахарида, который был продуцирован клеткой Bacillus, в которой имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза, для изготовления питательной композиции.
[43]Согласно шестому аспекту предложены питательные композиции, содержащие по меньшей мере один сиалированный олигосахарид, который продуцирован клеткой Bacillus, в которой имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза.
[44]Описание графических материалов
[45]На фиг. 1 проиллюстрированы разные воплощения пути биосинтеза CMP-NeuNAc, который осуществляется в клетке Bacillus для получения сиалированного олигосахарида.
[47]Согласно первому аспекту предложена неспорообразующая бактериальная клетка рода Bacillus для получения сиалированного олигосахарида. Для того, чтобы иметь способность продуцировать сиалированный олигосахарид, клетка Bacillus должна предоставлять сиалилтрансферазе субстрат-донор, содержащий группировку сиаловой кислоты, и субстрат-акцептор, представляющий собой дисахарид или олигосахарид, таким образом, чтобы сиалилтрансфераза могла переносить группировку сиаловой кислоты от субстрата-донора на указанный субстрат-акцептор, с образованием, вследствие этого, сиалированного олигосахарида.
[48]Следует понимать, что сиалированный олигосахарид, который предназначена продуцировать указанная клетка Bacillus, представляет собой целевой сиалированный олигосахарид, тогда как другие сиалированные олигосахариды, которые могут быть образованы за счет разнородности сиалилтрансферазы во время продукции желательного сиалированного олигосахарида в клетке Bacillus, считаются нежелательными сиалированными олигосахаридами или побочными продуктами.
[49]Клетка Bacillus для получения сиалированного олигосахарида представляет собой неспорообразующую клетку Bacillus. Клетки Bacillus дикого типа могут образовывать споры. Считают, что споруляция, а именно, процесс образования спор, у бактерий представляет собой реакцию бактериальной клетки, которая инициирует программу развития, приводящую к образованию дочерних клеток отличной морфологии и направления развития. Споруляцию Bacillus исследовали как основную модель дифференцировки клеток. Во время споруляции палочковидная клетка Bacillus делится ассиметрично, что приводит, вследствие этого, к получению двух генетически идентичных клеток с разной морфологией и направлениями развития.
[50]Однако, при промышленном получении не желательно, если бактериальный штамм - продуцент образует споры во время ферментативной продукции целевого продукта. Таким образом, предпочтительно использовать клетки Bacillus для получения сиалированных олигосахаридов, которые не способны образовывать споры. Такие клетки Bacillus называются «неспорообразующими».
[51]В одном воплощении неспорообразующая клетка Bacillus для получения сиалированного олигосахарида происходила из одного из штаммов В. subtilis, перечисленных в Таблице 1.
[52]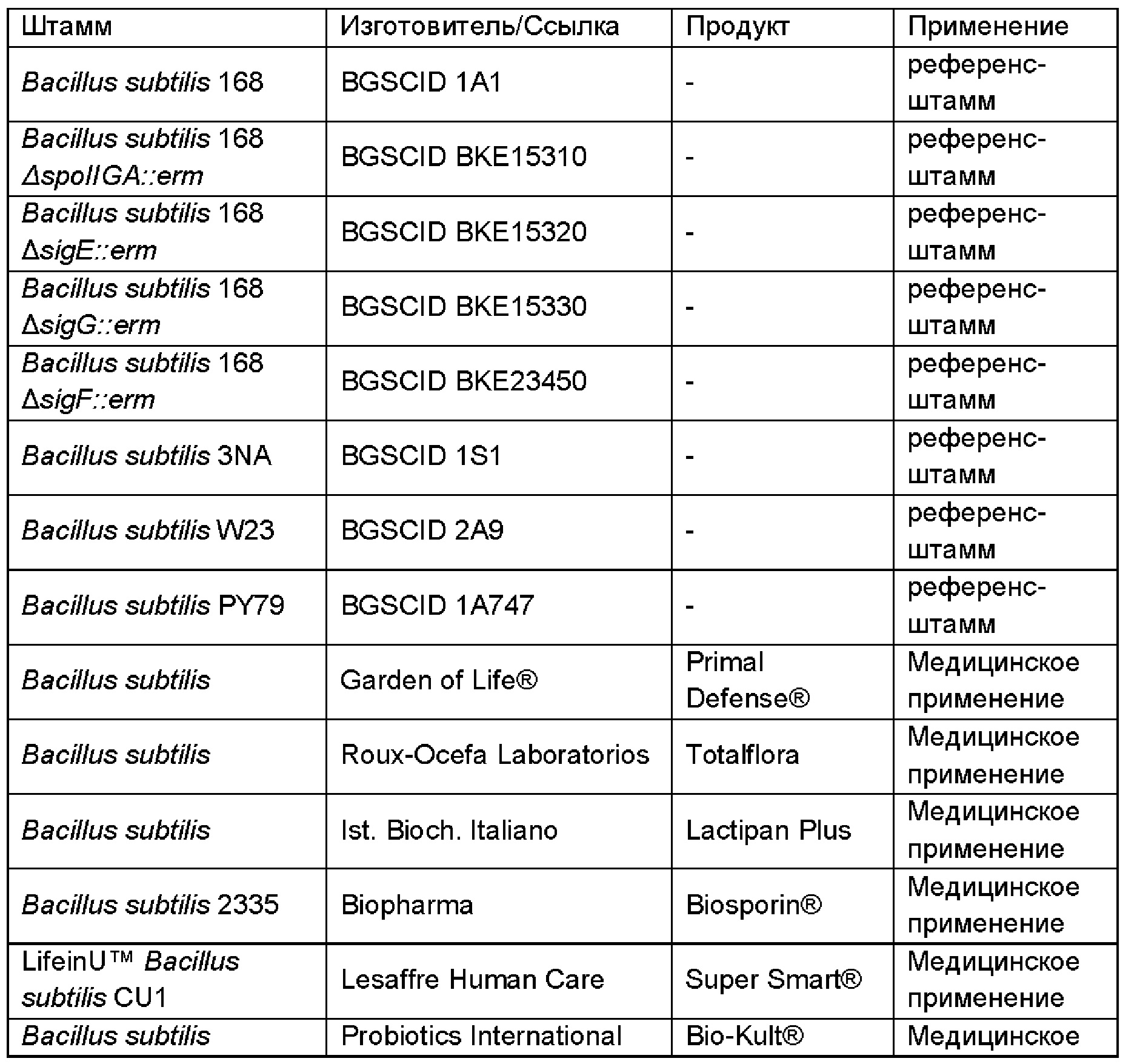
[53]
[54]В некоторых воплощениях клетка Bacillus генетически сконструирована так, чтобы стать неспорообразующей, например, посредством делеции или функциональной инактивации SpoOA. SpoOA представляет собой ДНК-связывающий белок, который влияет, напрямую или опосредовано, на экспрессию более чем 500 генов на протяжении ранней стадии споруляции. Подходящая функциональная инактивация SpoOA включает делецию участка фосфорилирования, где фосфотрансферазы SpoOF и SpoOB фосфорилируют SpoOA. Делеция или функциональная инактивация участка фосфорилирования фосфотрансферазы SpoOF и SpoOB приводит к функциональной инактивации SpoOA и, вследствие этого, нарушает способность клетки Bacillus образовывать споры. В качестве альтернативы, ген или нуклеотидная последовательность, кодирующая SpoOA, или часть гена или нуклеотидной последовательности, кодирующей SpoOA, могут быть удалены из генома клетки Bacillus.
[55]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована посредством делеции или функциональной инактивации гена(ов), кодирующего(их) фактор сигма SigE (sigE) и/или фактор сигма SigF (sigF). Факторы сигма SigE и SigF представляют собой транскрипционные факторы, которые участвуют в экспрессии генов, которые кодируют белки, которые участвуют в ранней фазе споруляции.
[56]Делеция или функциональная инактивация SpoOA, SigE и/или SigF нарушает способность клетки Bacillus образовывать споры. Такая неспорообразующая клетка Bacillus может быть использована в качестве предшественника для образования клетки Bacillus, которая способна продуцировать сиалированный олигосахарид.
[57]Клетки Bacillus дикого типа как не синтезируют лактозу внутриклеточно, так и не поглощают экзогенную лактозу. Однако, лактоза представляет собой субстрат-акцептор для группировки сиаловой кислоты посредством сиалилтрансферазы, акцептирующей лактозу, в образовании некоторых сиалированных олигосахаридов, таких как 3'-сиалилактоза (3-SL) или 6'-сиалилактоза (3-SL). Следовательно, для того, чтобы иметь способность продуцировать такие сиалированные олигосахариды, клетка Bacillus должна обладать способностью предоставления лактозы сиалилтрансферазе, акцептирующей лактозу, или посредством образования лактозы внутриклеточно и/или посредством поглощения лактозы извне. Корме того, лактоза обычно представляет собой дисахаридную группировку, которую несет большая часть, если не все, сиалированных ОГМ. Следовательно, поглощение лактозы также требуется для биосинтеза сиалированных ОГМ, отличных от трисахаридов, а именно, когда субстрат-акцептор для группировки NeuNAc представляет собой олигосахарид, а не дисахарид лактозу.
[58]В одном воплощении в клетке Bacillus для продуцирования сиалированного олигосахарида имеется лактозопермеаза для поглощения экзогенной лактозы. Следовательно, клетка Bacillus может поглощать экзогенную лактозу. В качестве альтернативы, клетка Bacillus может быть генетически сконструирована для внутриклеточного синтеза лактозы из глюкозы и галактозы, таким образом, что не будет необходимым экзогенное поступление лактозы для получения сиалированного олигосахарида.
[59]Термин «экзогенный» в отношении лактозы, в том виде, в котором он используется в данном документе, относится к лактозе, которая не происходит из клетки Bacillus для получения сиалированного олигосахарида, а именно, являясь внутриклеточно синтезированной указанной клеткой Bacillus, а которая происходит вне указанной клетки Bacillus, и которую добавляют к культуральной среде, в которой выращивают клетку Bacillus для получения сиалированного олигосахарида.
[60]В некоторых воплощениях клетка Bacillus генетически сконструирована для того, чтобы иметь способность поглощать экзогенную лактозу, а именно генетически сконструирована так, чтобы содержать лактозопермеазу. Таким образом, в клетке Bacillus для получения сиалированного олигосахарида имеется гетерологичная лактозопермеаза. Подходящая гетерологичная лактозопермеаза представляет собой LacY Е. coli или ее функциональный вариант.
[61]Термин «гетерологичный», в том виде, в котором он используется в данном документе, в отношении белков, полипептидов, ферментов и транспортеров, а также в отношении молекул нуклеиновой кислоты, нуклеотидных последовательностей и/или генов, относится к молекуле, которая не является нативной в отношении вида клетки Bacillus, которая содержит указанную молекулу. Термин «ненативный» указывает на то, что указанная молекула отсутствует в клетке-предшественнике Bacillus, встречающейся в природе или дикого типа, а именно, в клетке Bacillus того же вида, который наиболее часто встречается в природе. Таким образом, «гетерологичная последовательность» или «гетерологичная нуклеиновая кислота» или «гетерологичный полипептид», в том виде, в котором он используется в данном документе, представляет собой последовательность или нуклеиновую кислоту или пептид, которые происходят из источника, являющегося чужеродным в отношении клетки Bacillus (например, из другого вида), или, если из того же источника, модифицированы по сравнению со своей исходной формой. Гетерологичная последовательность может быть стабильно введена, например, посредством трансфекции, трансформации, конъюгации или трансдукции, в геном микробной клетки-хозяина, таким образом, представляя генетически сконструированную клетку-хозяина. Можно применять методики, которые будут зависеть от клетки-хозяина, в которую должна быть введена последовательность. Разные методики известны специалисту в данной области, и например, раскрыты в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989). Соответственно, «гетерологичный полипептид» представляет собой полипептид, который в природе не встречается в клетке, и «гетерологичная сиалилтрансфераза» представляет собой сиалилтрансферазу, которая не встречается в природе в микробной клетке.
[62]Термин «функциональный вариант», в том виде, в котором он используется в данном документе, в отношении ферментов и/или транспортных молекул, относится к белкам или полипептидам, обладающим такой же активностью (ферментативной, каталитической или транслоцирующей), что и референный фермент или молекула-транспортер, но который имеет аминокислотную последовательность, отличную от аминокислотной последовательности референсной молекулы фермента или транспортера. Таким образом, типичный вариант белка/полипептида отличается по аминокислотной последовательности от референсного белка/полипептида. Вариант и референсный белок/полипептид может отличаться по аминокислотной последовательности одной или более заменами, присоединениями и/или делециями в любой комбинации. Следовательно, термин «функциональный вариант» включает усеченные версии референсного белка/полипептида, которые обладают такой же активностью, как и референсный белок/полипептид. Замещенный или вставленный аминокислотный остаток может представлять собой или может не представлять собой аминокислотный остаток, кодируемый генетическим кодом. Вариант белка/полипептида может представлять собой встречающийся в природе, как например, аллельный вариант, или он может представлять собой вариант, который не известно, чтобы встречался в природе. Варианты белков/полипептидов, не встречающиеся в природе, могут быть созданы посредством методик мутагенеза, посредством прямого синтеза и посредством других методов генной инженерии, известных специалистам в данной области. В пределах объема настоящего раскрытия в термин «вариант» также включены белки и межвидовые гомологи, которые имеют аминокислотную последовательность, которая обладает более чем примерно 60%-ной идентичностью аминокислотных последовательностей, предпочтительно 65%-ной, 70%-ной, 75%-ной, 80%-ной, 85%-ной, 90%-ной, более предпочтительно 91%-ной, 92%-ной, 93%-ной, 94%-ной, 95%-ной, 96%-ной, 97%-ной, 98%-ной или 99%-ной или большей идентичностью аминокислотных последовательностей, предпочтительно, на протяжении области из по меньшей мере примерно 25, 50, 100, 200, 500, 1000 или более аминокислот, с референсным полипептидом.
[63]Термин «такая же активность», в том виде, в котором он используется в данном документе, относится к ферментативной, каталитической активности или активности транспортировки белка/полипептида лишь с точки зрения качества. Следовательно, «функциональный вариант» также включает варианты, которые обладают повышенной или пониженной активностью, по сравнению с активностью референсного белка/полипептида.
[64]В разных воплощениях клетка Bacillus генетически сконструирована так, что содержит и экспрессирует нуклеотидную последовательность, которая кодирует лактозопермеазу, предпочтительно нуклеотидную последовательность, которая кодирует лактозопермеазу LacY E.coli (UniProtKB- Р02920) или ее функциональный вариант.
[65]Лактозопермеаза LacY Е. coli кодируется областью, кодирующей белок (а именно, открытая рамка считывания) гена lacY Е. coli (номер доступа Gen Bank: NP_414877.1).
[66]Следовательно, в некоторых воплощениях клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, кодирующую область, кодирующую белок LacY Е. coli.
[67]В некоторых воплощениях частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную лактозопермеазу, приспособлена к частоте использования кодона Bacillus. Частота использования кодона В. subtilis, например, необычна тем, что суммарное содержание GC ниже примерно 45%, содержание GC первой буквы данных кодонов выше примерно 51%, содержание CG второй буквы данных кодонов ниже примерно 36,1% и содержание CG третьей буквы данных кодонов ниже примерно 46%.
[68]Для экспрессии лактозопермеазы клетка Bacillus содержит рекомбинантный ген лактозопермеазы, где нуклеотидная последовательность, которая кодирует лактозопермеазу, функционально связана с последовательностями контроля экспрессии, которые опосредуют экспрессию нуклеотидной последовательности, кодирующей лактозопермеазу.
[69]Термин «функционально связанный», в том виде, в котором он используется в данном документе, будет означать функциональную связь между нуклеотидной последовательностью, которая кодирует полипептид или белок (обычно называемой «областью, кодирующей белок», «открытой рамкой считывания» и иногда даже «геном») и второй нуклеотидной последовательностью (последовательностью контроля экспрессии, такой как промотор, сигнальная последовательность или ряд сайтов связывания транскрипционных факторов), которая влияет на транскрипцию и/или трансляцию нуклеотидной последовательности, которая кодирует полипептид или белок. Соответственно, термин «промотор» обозначает последовательности дезоксирибонуклеиновой кислоты (ДНК), которые обычно «предшествуют» открытой рамке считывания в ДНК-полимере и обеспечивают сайт инициации транскрипции в мРНК. «Регуляторные» последовательности ДНК, также обычно расположенные «выше» (то есть, предшествуя) открытой рамки считывания в данном ДНК-полимере, связывают белки, которые определяют частоту (или скорость) инициации транскрипции. В совокупности называемые «промоторной/регуляторной» или «контрольной» ДНК-последовательностью, данные последовательности, которые предшествуют выбранной открытой рамке считывания (или серии открытых рамок считывания) в функциональном ДНК-полимере способствуют определению того, будет ли происходить транскрипция (и в конечном итоге экспрессия) открытой рамки считывания. Последовательности ДНК, которые «следуют за» геном в ДНК-полимере и обеспечивают сигнал для терминации транскрипции в мРНК, называются последовательностями, «терминирующими» транскрипцию.
[70]Рекомбинантный ген лактозопермеазы может находиться, будучи интегрированным в хромосому Bacillus, или присутствовать в виде эписомальной версии на дополнительной плазмиде в клетке Bacillus.
[71]Экспрессия гетерологичного гена лактозопермеазы в клетке Bacillus позволяет полученной клетке Bacillus поглощать извне поставляемую лактозу из культуральной среды. Поглощенная лактоза может затем служить субстратом-акцептором для группировки сиаловой кислоты, подлежащей переносу сиалилтрансферазой, акцептирующей лактозу (см. ниже в данном документе), например, в образовании 3'-SL или 6'-SL.
[72]Для получения сиалированного олигосахарида Bacillus должна иметь способность предоставлять субстрат-донор для переноса группировки NeuNAc на субстрат-акцептор. Типичным субстратом-донором для группировки NeuNAc является CMP-NeuNAc. Следовательно, клетка Bacillus должна уметь внутриклеточно продуцировать CMP-NeuNAc для продукции сиалированных олигосахаридов. В случае внутриклеточного биосинтеза CMP-NeuNAc в клетке Bacillus имеется путь биосинтеза CMP-NeuNAc (Фиг. 1). Таким образом, клетка Bacillus генетически сконструирована так, чтобы иметь путь биосинтеза CMP-NeuNAc.
[73]Путь биосинтеза CMP-NeuNAc включает путь утилизации NeuNAc или путь биосинтеза сиаловой кислоты для внутриклеточного биосинтеза de novo NeuNAc. Следовательно, в клетке Bacillus имеется путь биосинтеза CMP-NeuNAc, включающий путь утилизации NeuNAc и/или путь биосинтеза сиаловой кислоты.
[74]Путь утилизации NeuNAc включает поглощение экзогенной сиаловой кислоты клеткой Bacillus и превращение поглощенной сиаловой кислоты в CMP-NeuNAc. Для поглощения экзогенной NeuNAc в клетке Bacillus имеется транспортер сиаловой кислоты. В некоторых воплощениях генетически сконструированная клетка Bacillus генетически сконструирована таким образом, чтобы имелся транспорт сиаловой кислоты для поглощения экзогенной NeuNAc. Подходящий транспортер сиаловой кислоты представляет собой NanT Е. coli (UniProtKB Р41036). NanT Е. coli катализирует протон-зависимый симпорт сиаловой кислоты. NanT может транспортировать NeuNAc, а также родственные сиаловые кислоты N-гликолилнейраминовую кислоту (NeuNGc) и 3-кето-3-дезокси-D-глицеро-D-галактононовую кислоту (KDN). В одном воплощении в генетически сконструированной клетке Bacillus имеется NanT Е. coli или его функциональный вариант.
[75]В некоторых воплощениях клетка Bacillus генетически сконструирована таким образом, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует транспортер сиаловой кислоты для поглощения экзогенной NeuNAc, предпочтительно, нуклеотидную последовательность, которая кодирует NanT Е. coli или его функциональный вариант.
[76]NanT Е. coli кодируется белок-кодирующей областью гена папТ Е. coli. Следовательно, в некоторых воплощениях клетка Bacillus генетически сконструирована таким образом, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует транспортер сиаловой кислоты NanT Е. coli или его функциональный вариант.
[77]Для экспрессии транспортера сиаловой кислоты клетка Bacillus содержит рекомбинантный ген транспортера сиаловой кислоты, где нуклеотидная последовательность, которая кодирует транспортер сиаловой кислоты, функционально связана с последовательностями контроля экспрессии, которые опосредуют экспрессию нуклеотидной последовательности, кодирующей транспортер сиаловой кислоты.
[78]Рекомбинантный ген транспортера сиаловой кислоты может присутствовать, будучи интегрированным в хромосому Bacillus, или присутствовать в виде эписомальной версии на дополнительной плазмиде в клетке Bacillus.
[79]В одном из воплощений частота использования кодона нуклеотидной последовательности, кодирующей транспортер сиаловой кислоты, адаптирована к частоте использования кодона Bacillus.
[80]В разных воплощениях путь биосинтеза CMP-NeuNAc включает путь биосинтеза сиаловой кислоты. Таким образом, в клетке Bacillus может иметься путь биосинтеза сиаловой кислоты для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты. Путь биосинтеза сиаловой кислоты включает ферментативные активности глутамин:фруктозо-6-фосфатаминотрансферазы (Фиг. 1:  ) и синтазы N-ацетилнейраминовой кислоты (тоже самое, что синтаза сиаловой кислоты) (Фиг. 1:
) и синтазы N-ацетилнейраминовой кислоты (тоже самое, что синтаза сиаловой кислоты) (Фиг. 1:  ). Следовательно, в клетке Bacillus для получения сиалированного олигосахарида есть глутамин:фруктозо-6-фосфатаминотрансфераза и синтаза N-ацетилнейраминовой кислоты.
). Следовательно, в клетке Bacillus для получения сиалированного олигосахарида есть глутамин:фруктозо-6-фосфатаминотрансфераза и синтаза N-ацетилнейраминовой кислоты.
[81]Фермент глутамин:фруктозо-6-фосфатаминотрансфераза (ЕС 2.6.1.16) катализирует превращение фруктозо-6-фосфата (Frc-6P) в глюкозамин-6-фосфат (GlcN-6P) с использованием глутамина (Фиг. 1: 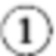 ). Обычно считается, что данная ферментативная реакция является первой стадией пути биосинтеза гексозамина. Альтернативными названиями глутамин:фруктозо-6-фосфатаминотрансферазы являются D-фруктозо-6-фосфатаминотрансфераза, GFAT, глюкозамин-6-фосфатсинтаза, гексозофосфатаминотрансфераза и L-глутамин-D-фруктозо-6-фосфатаминотрансфераза.
). Обычно считается, что данная ферментативная реакция является первой стадией пути биосинтеза гексозамина. Альтернативными названиями глутамин:фруктозо-6-фосфатаминотрансферазы являются D-фруктозо-6-фосфатаминотрансфераза, GFAT, глюкозамин-6-фосфатсинтаза, гексозофосфатаминотрансфераза и L-глутамин-D-фруктозо-6-фосфатаминотрансфераза.
[82]В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus имеется глутамин:фруктозо-6-фосфатаминотрансфераза, предпочтительно, гетерологичная глутамин:фруктозо-6-фосфатаминотрансфераза. Пример подходящей гетерологичной глутамин:фруктозо-6-фосфатаминотрансферазы происходит из Е. coli. Глутамин:фруктозо-6-фосфатаминотрансфераза Е. coli (UniProtKB - Р17169) обозначается GlmS. Следовательно, в клетке Bacillus имеется GlmS Е. coli или функциональный вариант GlmS Е. coli. Предпочтительно, функциональный вариант GlmS Е. coli представляет собой версию, которая демонстрирует значимо уменьшенную чувствительность к ингибированию глюкозамин-6-фосфата, по сравнению с ферментом дикого типа. Пример функционального варианта GlmS Е. coli, который демонстрирует значимо уменьшенную чувствительность к ингибированию глюкозамин-6-фосфата. Примеры функциональных вариантов GlmS Е. coli, которые демонстрируют значимо уменьшенную чувствительность к ингибированию глюкозамин-6-фосфата, представляют собой GlmS*54 и GlmS*, как описано в международной заявке №РСТ/ЕР2019/063669 (включена в данный документ посредством ссылки).
[83]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая кодирует глутамин:фуктозо-6-фосфатаминотрансферазу, предпочтительно глутамин:фруктозо-6-фосфатаминотрансферазу GlmS Е. coli, или нуклеотидную последовательность, кодирующую функциональный вариант GlmS Е. coli, который демонстрировал значимо пониженную чувствительность в отношении ингибирования глюкозамин-6-фосфата, по сравнению с ферментом дикого типа.
[84]Для экспрессии глутамин:фруктозо-6-фосфатаминотрансферазы клетка Bacillus содержит рекомбинантный ген глутамин:фруктозо-6-фосфатаминотрансферазы, где нуклеотидная последовательность, которая кодирует глутамин:фруктозо-6-фосфатаминотрансферазу, функционально связана с последовательностями контроля экспрессии, которые опосредуют экспрессию открытой рамки считывания глутамин:фруктозо-6-фосфатаминотрансферазы.
[85]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную глутамин:фруктозо-6-фосфатаминотрансферазу, адаптирована до частоты использования кодона Bacillus.
[86]Рекомбинантный ген глутамин:фуктозо-6-фосфатаминотрансферазы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
[87]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит синтазу сиаловой кислоты. Синтаза сиаловой кислоты катализирует конденсацию N-ацетилманнозамина (ManNAc) и фосфоенолпирувата (ФЕП) с N-ацетилнейраминовой кислотой (NeuNAc) (Фиг. 1:  ). Ферментативное образование NeuNAc представляет собой последнюю стадию пути биосинтеза сиаловой кислоты.
). Ферментативное образование NeuNAc представляет собой последнюю стадию пути биосинтеза сиаловой кислоты.
[88]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит синтазу сиаловой кислоты или ее функциональный вариант, предпочтительно гетерологичную синтазу сиаловой кислоты. Примеры синтаз сиаловой кислоты известны из множества видов бактерий, таких как Campylobacter jejuni, Streptococcus agalactiae, Butyrivibrio proteoclasticus, Methanobrevibacter ruminatium, Acetobacterium woodii, Desulfobacula toluolica, Escherichia coli, Prevotella nigescens, Halorhabdus tiamatea, Desulfotignum phosphitoxidans или Candidatus Scalindua sp., Idomarina loihiensis, Fusobacterium nucleatum или Neisseria meningitidis. Примером подходящей синтазы сиаловой кислоты является синтаза N-ацетилнейраминовой кислоты NeuB С.jejuni, как кодируется геном пеиВ С.jejuni.
[89]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует синтазу N-ацетилнейраминовой кислоты. Следовательно, нуклеотидная последовательность, которая кодирует синтазу N-ацетилнейраминовой кислоты, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует синтазу N-ацетилнейраминовой кислоты в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности синтазы N-ацетилнейраминовой кислоты.
[90]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную синтазу N-ацетилнейраминовой кислоты, адаптирована к частоте использования кодона Bacillus.
[91]Рекомбинантный ген синтазы N-ацетилнейраминовой кислоты может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
[93]Фосфоглюкозаминмутаза превращает глюкозамин-6-фосфат (GlcN-6P) в глюкозамин-1-фосфат (GlcN-1 Р).
[94]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована таким образом, чтобы содержать фосфоглюкозаминмутазу. Подходящая фосфоглюкозаминмутаза представляет собой фосфоглюкозаминмутазу GlmM Е. coli или ее функциональный вариант.Указанная GlmM Е. coli кодируется геном glmM Е. coli.
[95]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы в ней содержалась и экспрессировалась нуклеотидная последовательность, которая кодирует фосфоглюкозаминмутазу, предпочтительно, нуклеотидная последовательность, которая кодирует GlmM Е. coli или ее функциональный вариант.
[96]Фосфоглюкозаминмутаза GlmM Е. coli кодируется белок-кодирующей областью гена glmM Е. coli. Следовательно, клетка Bacillus генетически сконструирована для содержания и экспрессии нуклеотидной последовательности, которая кодирует GlmM Е. coli.
[97]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует фосфоглюкозаминмутазу. Следовательно, нуклеотидная последовательность, которая кодирует фосфоглюкозаминмутазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует фосфоглюкозаминмутазу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности фосфоглюкозаминмутазы.
[98]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную фосфоглюкозаминмутазу, адаптирована к частоте использования кодона Bacillus.
[99]Рекомбинантный ген фосфоглюкозаминмутазы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
[100]Глюкозамин-1-фосфат-N-ацетилтрансфераза катализирует перенос ацетильной группы с ацетил-коэнзима А на глюкозамин-1-фосфат (GlcN-1-P) с получением N-ацетилглюкозамин-1-фосфата (GlcNAc-1-P).
[101]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы содержать глюкозамин-1-фосфат-N-ацетилтрансферазу.
[102]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует глюкозамин-1-фосфат-N-ацетилтрансферазу.
[103]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует глюкозамин-1-фосфат-N-ацетилтрансферазу. Следовательно, нуклеотидная последовательность, которая кодирует глюкозамин-1-фосфат-N-ацетилтрансферазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует глюкозамин-1-фосфат-N-ацетилтрансферазу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности глюкозамин-1-фосфат-N-ацетилтрансферазы.
[104]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную глюкозамин-1-фосфат-N-ацетилтрансферазу, адаптирована к частоте использования кодона Bacillus.
[105]Рекомбинантный ген глюкозамин-1-фосфат-N-ацетилтрансферазы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
[106]N-ацетилглюкозамин-1-фосфатуридилтрансфераза превращает N-ацетилглюкозамин-1-фосфат (GlcNAc-1-P) в УДФ-GlcNAc посредством переноса уридин-5-монофосфата (с уридин 5-трифосфата).
[107]В дополнительном и/или альтернативном воплощении клетка генетически сконструирована для того, чтобы иметь N-ацетилглюкозамин-1-фосфатуридилтрансферазу.
[108]В дополнительном и/или альтернативном воплощении клетка генетически сконструирована для того, чтобы содержать или экспрессировать нуклеотидную последовательность, которая кодирует N-ацетилглюкозамин-1-фосфатуридилтрансферазу.
[109]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует N-ацетилглюкозамин-1-фосфатуридилтрансферазу.
[110]Следовательно, нуклеотидная последовательность, которая кодирует N-ацетилглюкозамин-1-фосфатуридилтрансферазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует N-ацетилглюкозамин-1-фосфатуридилтрансферазу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности N-ацетилглюкозамин-1-фосфатуридилтрансферазы.
[111]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-1-фосфатуридилтрансферазу, адаптирована к частоте использования кодона Bacillus.
[112]Рекомбинантный ген N-ацетилглюкозамин-1-фосфатуридилтрансферазы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
[113]В дополнительном и/или альтернативном воплощении глюкозамин-1-фосфат-N-ацетилтрансферазная активность и N-ацетилглюкозамин-1-фосфатуридилтрансферазная активность обеспечиваются бифункциональным ферментом. Примером таких бифункциональных ферментов является GlmU Е. coli. GlmU Е. coli катализирует по меньшей мере две последовательные реакции, которые превращают глюкозамин-1-фосфат в УДФ-GlcNAc (Фиг. 1:  ). С-концевой домен катализирует перенос ацетильной группы с ацетил-коэнзима А на глюкозамин-1-фосфат (GlcN-1-P) с получением N-ацетилглюкозамин-1-фосфата (GlcNAc-1-P), который превращается в УДФ-GlcNAc посредством переноса уридин-5-монофосфата (с уридин 5-трифосфата), реакция, катализируемая N-концевым доменом.
). С-концевой домен катализирует перенос ацетильной группы с ацетил-коэнзима А на глюкозамин-1-фосфат (GlcN-1-P) с получением N-ацетилглюкозамин-1-фосфата (GlcNAc-1-P), который превращается в УДФ-GlcNAc посредством переноса уридин-5-монофосфата (с уридин 5-трифосфата), реакция, катализируемая N-концевым доменом.
[114]Такой бифункциональный фермент также известен из Bacillus subtilis и Haemophilus influenzae.
[115]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы иметь гетерологичную бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-фосфатуридилтрансферазу. Подходящим примером является GlmU Е. coli или ее функциональный вариант (включая GlmU Н. influenzae). Указанная GlmU Е. coli кодируется геном glmU Е. coli.
[116]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать или сверхэкспрессировать нуклеотидную последовательность, которая кодирует указанный бифункциональный фермент, предпочтительно нуклеотидную последовательность, которая кодирует GlmU Е. coli или ее функциональный вариант.
[117]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-осфатуридилтрансферазу. Следовательно, нуклеотидная последовательность, которая кодирует бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-фосфатуридилтрансферазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-фосфатуридилтрансферазу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной глюкозамин-1-фосфат-N-ацетилтрансферазной активности и N-ацетилглюкозамин-1-фосфатуридилтрансферазной активности.
[118]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-фосфатуридилтрансферазу, адаптирована к частоте использования кодона Bacillus.
[119]Рекомбинантный ген бифункциональной глюкозамин-1-фосфат-N-ацетилтрансферазы/N-ацетилглюкозамин-1-фосфатуридилтрансферазы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
[120]В дополнительном и/или альтернативном воплощении путь биосинтеза сиаловой кислоты включает превращение УДФ-GlcNAc в N-ацетилманнозамин (ManNAc). Данное превращение может быть катализировано УДФ-N-ацетилглюкозамин-2-эимеазой, которая не только превращает УДФ-N-ацетилглюкозамин в УДФ-N-ацетилманнозамин, но одновременно высвобождает УДФ (Фиг. 1:  ).
).
[121]Следовательно, клетка Bacillus содержит УДФ-N-ацетилглюкозамин-2-эпимеразу, которая одновременно высвобождает УДФ.
[122]Подходящая УДФ-N-ацетилглюкозамин-2-эпимераза с сопутствующим высвобождением УДФ представляет собой УДФ-N-ацетилглюкозамин-2-эпимеразу NeuC Campylobacter jejuni, кодируемую геном пеиС С.jejuni.
[123]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы иметь УДФ-N-ацетилглюкозамин-2-эпимеразу с сопутствующим высвобождением УДФ.
[124]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует УДФ-N-ацетилглюкозамин-2-эпимеразу, которая одновременно высвобождает УДФ, предпочтительно чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует NeuC С, jejuni или ее функциональный вариант.
[125]УДФ-N-ацетилглюкозамин-2-эпимераза NeuC С.jejuni кодируется белок-кодирующей областью гена пеиС С.jejuni. Следовательно, клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует NeuC С.jejuni.
[126]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует УДФ-N-ацетилглюкозамин-2-эпимеразу с сопутствующим высвобождением УДФ во время ее ферментативной реакции с высвобождением ManNAc. Следовательно, нуклеотидная последовательность, которая кодирует УДФ-N-ацетилглюкозамин-2-эпимеразу, которая одновременно высвобождает УДФ, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует указанную УДФ-N-ацетилглюкозамин-2-эпимеразу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности УДФ-N-ацетилглюкозамин-2-эпимеразы.
[127]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную УДФ-N-ацетилглюкозамин-2-эпимеразу, адаптирована к частоте использования кодона Bacillus.
[128]Рекомбинантный ген УДФ-N-ацетилглюкозамин-2-эпимеразы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
[129]В альтернативном воплощении в пути биосинтеза сиаловой кислоты используется N-ацетилглюкозамин-6-фосфат (GlcNAc-6-P) в качестве промежуточного соединения, но не используется УДФ-GlcNAc. В генетически сконструированной клетке Bacillus имеется путь биосинтеза сиаловой кислоты для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты, в котором используется GlcNAc-6-P в качестве промежуточного соединения, имеется глюкозамин-6-фосфат-N-ацетилтрансфераза (Фиг. 1: 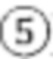 ). В пути биосинтеза сиаловой кислоты, использующем глюкозамин-6-фосфат-N-ацетилтрансферазу для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты, не используется УДФ-GlcNAc для биосинтеза сиаловой кислоты.
). В пути биосинтеза сиаловой кислоты, использующем глюкозамин-6-фосфат-N-ацетилтрансферазу для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты, не используется УДФ-GlcNAc для биосинтеза сиаловой кислоты.
[130]Путь биосинтеза сиаловой кислоты, использующий GlcNAc-6P, включает активности ферментов глутамин:фруктозо-6-фосфатаминотрансферазы (Фиг. 1:  ) и синтазы N-ацетилнейраминовой кислоты (Фиг. 1:
) и синтазы N-ацетилнейраминовой кислоты (Фиг. 1:  ). Указанный путь биосинтеза сиаловой кислоты дополнительно включает а) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:
). Указанный путь биосинтеза сиаловой кислоты дополнительно включает а) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1: 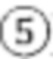 ), N-ацетилглюкозамин-6-фосфатфосфатазы (Фиг. 1:
), N-ацетилглюкозамин-6-фосфатфосфатазы (Фиг. 1:  ) и N-ацетилглюкозамин-2-эпимеразы (Фиг. 1:
) и N-ацетилглюкозамин-2-эпимеразы (Фиг. 1:  ) или b) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:
) или b) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:  ), N-ацетилглюкозамин-6-фосфатэпимеразы (Фиг. 1:
), N-ацетилглюкозамин-6-фосфатэпимеразы (Фиг. 1:  ) и N-ацетилманнозамин-6-фосфатфосфатазы (Фиг. 1:
) и N-ацетилманнозамин-6-фосфатфосфатазы (Фиг. 1:  ). Таким образом, необязательно, чтобы генетически сконструированная клетка Bacillus обладала ферментативными активностями фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ-N-ацетилглюкозамин 2-эпимеразы с сопутствующим высвобождением УДФ для внутриклеточного биосинтеза сиаловой кислоты. Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus, способная синтезировать сиаловую кислоту, не содержит одной или более активностей ферментов, выбранных из группы, состоящей из активностей ферментов фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ N-ацетилглюкозамин-2-эпимеразы с сопутствующим высвобождением УДФ.
). Таким образом, необязательно, чтобы генетически сконструированная клетка Bacillus обладала ферментативными активностями фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ-N-ацетилглюкозамин 2-эпимеразы с сопутствующим высвобождением УДФ для внутриклеточного биосинтеза сиаловой кислоты. Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus, способная синтезировать сиаловую кислоту, не содержит одной или более активностей ферментов, выбранных из группы, состоящей из активностей ферментов фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ N-ацетилглюкозамин-2-эпимеразы с сопутствующим высвобождением УДФ.
[131]В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus имеется глюкозамин-6-фосфат-N-ацетилтрансферазная активность. Указанная глюкозамин-6-фосфат-N-ацетилтрансферазная активность превращает GlcN-6P в N-ацетилглюкозамин-6-фосфат (GlcNAc-6P). Примером глюкозамин-6-фосфат-N-ацетилтрансферазы является Gna1 Saccharomyces cerevisiae (UniProtKB - P43577).
[132]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит глюкозамин-6-фосфат N-ацетилтрансферазу, предпочтительно, гетерологичную глюкозамин-6-фосфат-N-ацетилтрансферазу, более предпочтительно Gna1 из S. cerevisiae или ее функциональный вариант.
[133]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую глюкозамин-6-фосфат-N-ацетилтрансферазу, предпочтительно, Gna1 S. cerevisiae, где указанная нуклеотидная последовательность функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности глюкозамин-1-фосфат-N-ацетилтрансферазы.
[134]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную глюкозамин-6-фосфат-N-ацетилтрансферазу, адаптирована к частоте использования кодона Bacillus.
[135]Рекомбинантный ген глюкозамин-6-фосфат-N-ацетилтрансферазы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
[136]В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus имеется N-ацетилглюкозамин-6-фосфатфосфатазная активность. Указанная N-ацетилглюкозамин-6-фосфатфосфатазная активность превращает GlcNAc-6P в N-ацетилглюкозамин (GlcNAc). Примерами N-ацетилглюкозамин-6-фосфатфосфатазы являются сахарофосфатазы HAD-подобного суперсемейства, которые катализируют превращение GlcNAc6P в GlcNAc. HAD-подобное суперсемейство ферментов названо в честь бактериального фермента -дегидрогеназы галогенокислоты и включает фосфатазы. Подходящая фосфатаза HAD-подобного суперсемейства, катализирующего превращение GlcNAc6P в GlcNAc, может быть выбрана из группы, состоящей из фруктозо-1-фосфатфосфатазы (YqaB, UniProtKB - Р77475) и альфа-D-глюкозо-1-фосфатфосфатазы (YihX, UniProtKB - P0A8Y3). Считают, что ферменты YqaB Е. coli и YihX E.coli также действуют на GlcNAc6P (Lee, S.-W. and Oh, M.-K. (2015) Metabolic Engineering 28: 143-150).
[137]В дополнительном и/или альтернативном воплощении сахарофосфатаза HAD-подобного суперсемейства, катализирующего превращение GlcNAc-6P в GlcNAc, представляет собой гетерологичный фермент в генетически сконструированной клетке Bacillus. В дополнительном и/или альтернативном воплощении сахарофосфатаза HAD-подобного суперсемейства, катализирующего превращение GlcNAc6P в GlcNAc, выбрана из группы, состоящей из YqaB Е. coli, YihX Е. coli и их функциональных вариантов.
[138]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, которая содержит и экспрессирует нуклеотидную последовательность, кодирующую сахарофосфатазу HAD-подобного суперсемейства, катализирующего превращение GlcNAc-6P в GlcNAc. В дополнительном и/или альтернативном воплощении нуклеотидная последовательность, кодирующая сахарофосфатазу HAD-подобного суперсемейства, катализирующего превращение GlcNAc-6P в GlcNAc, представляет собой гетерологичную нуклеотидную последовательность. В дополнительном и/или альтернативном воплощении нуклеотидная последовательность, кодирующая сахарофосфатазу HAD-подобного суперсемейства, катализирующего превращение GlcNAc-6P в GlcNAc, кодирует YqaB Е. coli или YihX Е. coli или функциональный вариант одного или двух данных ферментов.
[139]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-6-фосфатфосфатазу, адаптирована к частоте использования кодона Bacillus.
[140]Рекомбинантный ген N-ацетилглюкозамин-6-фосфатфосфатазы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
[141]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus обладает N-ацетилглюкозамин-2-эпимеразной активностью. N-ацетилглюкозамин-2-эпимераза (ЕС 5.1.3.8) представляет собой фермент, который катализирует превращение N-ацетилглюкозамина (GlcNAc) в N-ацетилманнозамин (ManNAc). Фермент представляет собой рацемазу, оказывающую действие на углеводы и их производные. Систематическое название данного класса ферментов представляет собой N-ацил-D-глюкозамин 2-эпимеразу. Данный фермент участвует в метаболизме аминосахаров и метаболизме нуклеотидных Сахаров, предпочтительно гетерологичная N-ацетилглюкозамин 2-эпимераза.
[142]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит N-ацетилглюкозамин-2-эпимеразу, предпочтительно гетерологичную N-ацетилглюкозамин-2-эпимеразу. Примеры N-ацетилглюкозамин-2-эпимераз описаны у Anabena variabilis, Acaryochloris sp., Nostoc sp., Nostoc punctiforme, Bacteroides ovatus или Synechocystis sp.Пример подходящей N-ацетилглюкозамин 2-эпимеразы представляет собой N-цетилглюкозамин 2-эпимеразу В. ovatus АТСС 8483 (UniProtKB - A7LVG6), как кодируется геном BACOVA_01816. Еще одним примером является N-ацетилглюкозамин 2-эпимераза Synechocystis sp.(штамм РСС 6803) (UniProtKB - Р74124), которая также известна, как ренин-связывающий белок и кодируется геном slr1975.
[143]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая кодирует N-ацетилглюкозамин 2-эимеразу, предпочтительно, N-ацетилглюкозамин-2-эпимеразу В. ovatus АТСС 8483 или Synechocystis sp.(штамм РСС 6803) или ее функциональный вариант.
[144]Следовательно, нуклеотидная последовательность, которая кодирует N-ацетилглюкозамин-2-эпимеразу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует N-ацетилглюкозамин-2-эпимеразу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности N-ацетилглюкозамин-2-эпимеразы.
[145]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-2-эпимеразу, адаптирована к частоте использования кодона Bacillus.
[146]Рекомбинантный ген N-ацетилглюкозамин-2-эпимеразы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
[147]В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus имеется N-ацетилглюкозамин-6-фосфатэпимеразная активность и N-ацетилманнозамин-6-фосфатфосфатазная активность. N-ацетилглюкозамин-6-фосфатэпимераза превращает N-ацетилглюкозамин-6-фосфат (GlcNAc-6P) в N-ацетилмоннозамин-6-фосфат (ManNAc-6P), тогда как N-ацетилманнозамин-6-фосфатфосфатаза дефосфорилирует ManNAc-6P с получением N-ацетилмоннозамина (ManNAc). Обладание N-ацетилглюкозамин-6-фосфатэпимеразная активность и N-ацетилглюкозамин-6-фосфатфосфатазная активность обеспечивает дополнительный или альтернативный путь для обеспечения ManNAc для продукции Neu5Ac.
[148]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит N-ацетилглюкозамин-6-фосфатэпимеразу. Примером подходящей N-ацетилглюкозамин-6-фосфатэпимеразы является NanE Е. coli (UniprotKB Р0А761), как кодируется геном папЕ Е. coli.
[149]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую N-ацетилглюкозамин-6-фосфатэпимеразу, предпочтительно нуклеотидную последовательность, кодирующую NanE E.coli или ее функциональный вариант.
[150]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую N-ацетилглюкозамин-6-фосфатэпимеразу, где указанная нуклеотидная последовательность функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности в генетически сконструированной микробной клетке с обеспечением внутриклеточной активности N-ацетилглюкозамин-2-фосфатэпимеразы.
[151]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-6-фосфатэпимеразу, адаптирована к частоте использования кодона Bacillus.
[152]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит N-ацетилглюкозамин-6-фосфатфосфатазу, которая превращает ManNAc-6P в ManNAc.
[153]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую N-ацетилманнозамин-6-фосфатфосфатазу. Следовательно, нуклеотидная последовательность, которая кодирует N-ацетилгманнозамин-6-фосфатфосфатазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует N-ацетилглюкозамин-6-фосфатфосфатазу, в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности N-ацетилглюкозамин-6-фосфатфосфатазы.
[154]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-6-фосфатфосфатазу, адаптирована к частоте использования кодона Bacillus.
[155]Рекомбинантный ген N-ацетилманнозамин-6-фосфатфосфатазы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
[156]В генетически сконструированной клетке Bacillus имеется активность синтетазы цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты (Фиг. 1:  ) для переноса цитидин-5'-монофосфата на N-ацетилнейраминовую кислоту с образованием СМР-активированной N-ацетилнейраминовой кислоты (CMP-NeuNAc). Несколько синтетаз 5'-монофосфо-(СМР)-сиаловой кислоты известны в данной области и описаны, например, синтетазы 5'-монофосфо-(СМР)-сиаловой кислоты из Е. coli, Neisseria meningitidis, Campylobacter jejuni, Streptococcus sp.и т.д.
) для переноса цитидин-5'-монофосфата на N-ацетилнейраминовую кислоту с образованием СМР-активированной N-ацетилнейраминовой кислоты (CMP-NeuNAc). Несколько синтетаз 5'-монофосфо-(СМР)-сиаловой кислоты известны в данной области и описаны, например, синтетазы 5'-монофосфо-(СМР)-сиаловой кислоты из Е. coli, Neisseria meningitidis, Campylobacter jejuni, Streptococcus sp.и т.д.
[157]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит синтетазу цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты, предпочтительно, гетерологичную синтетазу цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты, более предпочтительно N-ацетилнейраминатцитидилтрансферазу NeuA из С.jejuni. NeuA С.jejuni кодируется геном neuA С. jejuni.
[158]Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую синтетазу цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты, где указанная нуклеотидная последовательность функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности в генетически сконструированной микробной клетке с обеспечением активности N-ацетилнейраминатцитидилтрансферазы.
[159]В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную синтетазу цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты, адаптирована к частоте использования кодона Bacillus.
[160]Рекомбинантный ген синтетазы цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
[161]В генетически сконструированной клетке Bacillus имеется сиалилтрансфераза, предпочтительно гетерологичная сиалилтрансфераза и более предпочтительно сиалилтрансферазная активность, выбранная из группы, состоящей из α-2,3-сиалилтрансферазной активности, α-2,6-сиалилтрансферазной активности и/или α-2,8-сиалилтрансферазной активности. Сиалилтрансферазная активность может переносить группировку N-ацетилнейраминовой кислоты с CMP-NeuNAc на акцепторную молекулу, где указанная акцепторная молекула представляет собой молекулу сахарида, с получением сиалированного сахарида.
[162]В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка содержит по меньшей мере одну сиалилтрансферазу, предпочтительно по меньшей мере одну гетерологичную сиалилтрансферазу, где указанная сиалилтрансфераза может обладать α-2,3-сиалилтрансферазной активностью и/или α-2,6-сиалилтрансферазной активностью и/или α-2,8-сиалилтрансферазной активностью для переноса группировки NeuNAc с CMP-NeuNAc в качестве субстрата-донора на акцепторный сахарид. Иллюстративные сиалилтрансферазы и их гены идентифицированы в Таблице 2.
[163]Термин «сиалилтрансфераза», в том виде, в котором он используется в данном документе, относится к полипептидам, способным обладать сиалилтрансферазной активностью. «Сиалилтрансферазная активность» относится к переносу остатка сиаловой кислоты, предпочтительно остатка N-ацетилнейраминовой кислоты (Neu5Ac), с субстрата-донора на акцепторную молекулу. Термин «сиалилтрансфераза» включает функциональные фрагменты сиалилтрансфераз, описанных в данном документе, функциональные варианты сиалилтрансфераз, описанных в данном документе, и функциональные фрагменты функциональных вариантов. «Функциональный» в данном отношении означает, что фрагменты и/или варианты могут обладать сиалилтрансферазной активностью. Функциональные фрагменты сиалилтрансферазы охватывают усеченные версии сиалилтрансферазы, как кодируется их геном, встречающимся в природе, усеченная версия которого может обладать сиалилтрансферазной активностью. Примерами усеченных версий являются сиалилтрансферазы, которые не содержат так называемой лидерной последовательности, которая обычно направляет полипептид к конкретной внутриклеточной локализации. Обычно такие лидерные последовательности удаляют из полипептида во время его внутриклеточного транспорта, и они также отсутствуют в зрелой сиалилтрансферазе, встречающейся в природе.
[164]Гетерологичная сиалилтрансфераза может переносить остаток сиаловой кислоты с субстрата-донора на молекулу-акцептор. Термин «может» в отношении гетерологичной сиалилтрансферазы относится к сиалилтрансферазной активности гетерологичной сиалилтрансферазы и условию, что подходящие условия реакции требуются для гетерологичной сиалилтрансферазы для обладания ее ферментативной активностью. В отсутствии подходящих условий реакции гетерологичная сиалилтрансфераза не обладает своей ферментативной активностью, но сохраняет свою ферментативную активность и обладает своей ферментативной активностью, когда восстанавливают подходящие условия реакции. Подходящие условия реакции включают наличие подходящего субстрата-донора, наличие подходящих молекул-акцепторов, наличие существенных кофакторов, таких как, например, одновалентные или двухвалентные ионы, значение рН в соответствующем диапазоне, подходящую температуру и тому подобное. Не обязательно, чтобы оптимальные значения для каждого фактора, влияющего на ферментативную реакцию гетерологичной сиалилтрансферазы, были удовлетворены, но условия реакции должны быть такими, чтобы гетерологичная сиалилтрансфераза осуществляла свою ферментативную активность. Соответственно, термин «может» исключает любые условия, при которых ферментативная активность гетерологичной сиалилтрансферазы необратимо нарушена, и также исключено воздействие на гетерологичную сиалилтрансферазу любого такого условия. Напротив, термин «может» означает, что сиалилтрансфераза является ферментативно активной, а именно, обладает своей сиалилтрансферазной активностью, если пермиссивные условия реакции (где все требования, являющиеся необходимыми для того, чтобы сиалилтрансфераза реализовывала свою ферментативную активность) предоставлены сиалилтрансферазе.
[165]Сиалилтрансферазы можно различить по типу связи с сахаром, которую они образуют. В том виде, в котором они используются в данном документе, термины «α-2,3-сиалилтрансфераза» и «α-2,3-сиалилтрансферазная активность» относятся к полипептидам и их ферментативной активности, которые добавляют остаток сиаловой кислоты с α-2,3-связью к галактозе, N-ацетилгалактозамину или галактозе или остатку N-ацетилгалактозамина акцепторной молекулы. Аналогично, термины «α-2,6-сиалилтрансфераза» и «α-2,6-сиалилтрансферазная активность» относятся к полипептидам и их ферментативной активности, которые добавляют остаток сиаловой кислоты с α-2,6-связью к галактозе, N-ацетилгалактозамину или галактозе или остатку N-ацетилгалактозамина акцепторной молекулы. Аналогично, термины «α-2,8-сиалилтрансфераза» и «α-2,8-сиалилтрансферазная активность» относятся к полипептидам и их ферментативной активности, которые добавляют остаток сиаловой кислоты с α-2,8-связью к галактозе, N-ацетилгалактозамину или галактозе или остатку N-ацетилгалактозамина акцепторной молекулы.
[166]Кроме того, генетически сконструированная клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, кодирующую гетерологичную сиалилтрансферазу. С этой целью нуклеотидная последовательность, кодирующая гетерологичную сиалилтрансферазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, кодирующей гетерологичную сиалилтрансферазу, в генетически сконструированной клетке Bacillus с получением внутриклеточной сиалилтрансферазной активности.
[167]В еще одном воплощении гетерологичная сиалилтрансфераза может обладать α-2,6-сиалилтрансферазной активностью.
[168]В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus содержится и экспрессируется молекула нуклеиновой кислоты, которая содержит по меньшей мере одну нуклеотидную последовательность, кодирующую указанную гетерологичную сиалилтрансферазу, способную обладать α-2,6-сиалилтрансферазной активностью.
[169]В дополнительном и/или альтернативном воплощении гетерологичная сиалилтрансфераза может обладать α-2,8-сиалилтрансферазной активностью. Примером гетерологичной сиалилтрансферазы, которая способна обладать α-2,8-сиалилтрансферазной активностью, является сиалилтрансфераза Cstll OH4384Campylobacter jejuni.
[170]Сиалилтрансфераза может переносить остаток сиаловой кислоты, например, остаток N-ацетилнейраминовой кислоты (Neu5Ac), от субстрата-донора, например, CMP-Neu5Ac, на акцепторную молекулу. Акцепторная молекула представляет собой молекулу сахарида, предпочтительно молекулу сахарида, изложенную в Таблице 3.
[171]В дополнительном и/или альтернативном воплощении в генетически сконструированной микробной клетке Bacillus содержится молекула нуклеиновой кислоты, которая содержит и экспрессирует по меньшей мере одну нуклеотидную последовательность, кодирующую указанную гетерологичную сиалилтрансферазу, способную обладать α-2,3-сиалилтрансферазной активностью.
[172]
[173]
[174]В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой моносахарид, предпочтительно моносахарид, выбранный из группы, состоящей из N-ацетилглюкозамина, галактозы и N-ацетилгалактозамина.
[175]В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой дисахарид, предпочтительно дисахарид, выбранный из группы, состоящей из лактозы, лактулозы, N-ацетиллактозамина, лакто-N-биозы, лактулозы и мелибиозы.
[176]В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой трисахарид, предпочтительно трисахарид, выбранный из группы, состоящей из рафинозы, лакто-N-триозы II, 2'-фукозиллактозы, 3-фукозиллактозы, 3'-сиалиллактозы, 6'-сиалиллактозы, 3'-сиалил-N-
[177]ацетиллактозамина, 6'-сиалил-N-ацетиллактозамина, 3'-галактозиллактозы и 6'-галактозиллактозы.
[178]
[179]
[180]
[181]В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой тетрасахарид, предпочтительно тетрасахарид, выбранный из группы, состоящей из лакто-N-тетраозы, лакто-N-неотетраозы, 2'3-дифукозиллактозы, 3-фукозил-3'-сиалиллактозы и 3-фукозил-6'-сиалиллактозы.
[182]В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой пентасахарид, предпочтительно пентасахарид, выбранный из группы, состоящей из сиалиллакто-N-тетраозы а, сиалиллакто-N-тетраозы b, сиалиллакто-N-тетраозы с, лакто-N-фукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III, лакто-N-фукопентаозы V, лакто-N-неофукопентаозы I и лакто-N-неофукопентаозы V.
[183]Следует понимать, что клетка Bacillus, уже несущая один или более генов, кодирующих указанные ферменты образом, достаточным для продукции NeuNAc, CMP-NeuNAc и/или сиалированного сахарида, не нуждается в генетической модификации для совершения биосинтеза сиаловой кислоты и для переноса группировки сиаловой кислоты на акцептор-сахарид, но, тем не менее, может быть генетически сконструирована для изменения уровня экспрессии одного или более из указанных генов для повышения внутриклеточного уровня продуктов указанного одного или более генов, таких как, например, количество глутамин:фруктозо-6-фосфатаминотрансфеаза, глюкозамин-6-фосфат N-ацетилтрансфераза, N-ацетилглюкозамин-6-фосфатфосфатаза, N-ацетилглюкозамин 2-эпимераза и/или синтетаза N-ацетилнейраминовой кислоты, с повышением, таким образом, скорости биосинтеза Neu5Ac, и, как следствие, сиалированного сахарида, в генетически сконструированной клетке.
[184]В некоторых воплощениях клетка Bacillus предназначена для применения в получении 3'-SL и генетически сконструирована для того, чтобы иметь лактозопермеазу, путь биосинтеза CMP-NeuNAc, в котором используется GlcN-1P в качестве промежуточного соединения, и α-2,3-сиалилтрансферазу.
[185]В разных воплощениях клетка Bacillus предназначена для применения в получении 6'-SL и генетически сконструирована для того, чтобы иметь лактозопермеазу, путь биосинтеза CMP-NeuNAc, в котором используется GlcN-1P в качестве промежуточного соединения, и α-2,6-сиалилтрансферазу.
[186]В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка Bacillus синтезирует больше ФЕП, чем клетка дикого типа. В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка генетически сконструирована для того, чтобы имелся усиленный путь биосинтеза ФЕП. Предпочтительно, генетически сконструированная микробная клетка генетически сконструирована для обладания повышенной активностью синтазы фосфоенолпирувата, например, в том, что ген ppsA, кодирующий фосфоенолпируватсинтазу, сверхэкспрессируется, и/или в том, что микроорганизмы, не встречающиеся в природе, содержат по меньшей мере одну дополнительную копию нуклеотидной последовательности, делающую возможной экспрессию фосфоенолпируватсинтазы или ее функционального варианта. Сверхэкспрессия ppsA усиливает внутриклеточный синтез ФЕП таким образом, что больше ФЕП доступно для продукции сиаловой кислоты. Например, подходящая фосфоенолпируватсинтаза представляет собой PpsA Е. coli.
[187]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую PpsA Е. coli или ее функциональный вариант.Указанная нуклеотидная последовательность, кодирующая PpsA Е. coli или ее функциональный вариант, обладает идентичностью последовательностей по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% с геном ppsA Е. coli.
[188]В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus дополнительно модифицирована для того, чтобы иметь способность переносить указанный один единственный источник углерода в клетку посредством механизма, при котором не потребляется ФЕП.
[189]В дополнительном и/или альтернативном воплощении клетка Bacillus для получения сиалированного олигосахарида не обладает β-галактозидазной активностью или обладает пониженной β-галактозидазной активностью, по сравнению с клеткой Bacillus дикого типа того же вида.
[190]Внутриклеточный биосинтез сиалированных олигосахаридов требует импортирования лактозы в качестве субстрата-акцептора для сиалилтрансферазы, акцептирующей лактозу. Любая внутриклеточная активность фермента, который гидролизует поглощенную лактозу, будет воздействовать на эффективность образования сиалиллактозы, поскольку пул внутриклеточной лактозы будет уменьшен. Таким образом, будет преимущественным, если клетка Bacillus для получения сиалированного олигосахарида не будет обладать или будет обладать по меньшей мере, по сравнению с клеткой Bacillus дикого типа, сниженной активностью бета-галактозидазы.
[191]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для исключения или по меньшей мере уменьшения р-галактозидазной активности клетки.
[192]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована посредством делеции или функциональной инактивации гена ganA. В еще одном воплощении клетка Bacillus генетически сконструирована для уменьшения уровня экспрессии гена ganA, по сравнению с клеткой Bacillus дикого типа.
[193]Ген ganA Bacillus также называется yvfN или lacA. Это ген регулона GanR, который содержит гены, кодирующие ферменты, участвующие в утилизации галактана. Ген ganA кодирует бета-галактозидазу, которая участвует в утилизации галактана Bacillus.
[194]Делеция или функциональная инактивация гена ganA аннулирует GanA-опосредованную β-галактозидазную активность в клетке Bacillus, тогда как уменьшение уровня экспрессии ganA уменьшает количество GanA в клетке Bacillus и, следовательно, активность β-галактозидазы, которая могла бы мешать биосинтезу сиалированного олигосахарида.
[195]В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована посредством удаления или функциональной инактивации гена yesZ. Ген yesZ Bacillus кодирует бета-галактозидазу YesZ, которая играет роль в деградации рамногалактуронана, происходящего из клеточных стенок растений. Экспрессия гена yesZ Bacillus индуцируется рамногалактуронаном I. В еще одном воплощении клетка Bacillus генетически сконструирована для уменьшения уровня экспрессии гена yesZ, по сравнению с клеткой Bacillus дикого типа.
[196]Удаление или функциональная инактивация гена yesZ аннулирует YesZ-опосредованную р-галактозидазную активность в клетке Bacillus, тогда как уменьшение уровня экспрессии yesZ уменьшает количество YesZ в клетке Bacillus и, следовательно, активность β-галактозидазы, которая могла бы мешать биосинтезу сиалированного олигосахарида.
[197]Когда В. subtilis вступает в постэкспоненциальную фазу роста, они (начинают) продуцировать большие количества внеклеточных протеаз. Чужеродные белки часто являются чувствительными к протеазе. Таким образом, штамм, не содержащий экзопротеазу, является желательным для повышения стабильности гетерологичных белков и для обеспечения аккумуляции высоких уровней чужеродных белков. Геном Bacillus кодирует по меньшей мере восемь внеклеточных протеаз, а именно nprE, aprE, epr, bpr, mpr, nprB, vpr и wprA. Таким образом, в дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована в том, что по меньшей мере один ген, кодирующий внеклеточную протеазу, был удален или функционально инактивирован, предпочтительно по меньшей мере один из генов, выбранных из группы, состоящей из nprE, aprE, epr, bpr, mpr, nprB, vpr и wprA. Предпочтительно, два, три, четыре, пять, шесть, семь, или восемь из генов, выбранных из группы, состоящей из nprE, aprE, epr, bpr, mpr, nprB, vpr и wprA, удалены или функционально инактивированы.
[198]В, subtiiis синтезирует пульхерриминовую кислоту, когда растет в средах, содержащих углевод, такой как глюкоза или лактоза. Выделяемая пульхерриминовая кислота образует красный пигмент пульхерримин, соль пульхерриминовой кислоты (хелат железа (III)), когда железо находится в среде для выращивания. Образования данного нежелательного побочного продукта во время процессов ферментации можно избежать/аннулировать посредством удаления/нарушения генов yvmC и/или сурХ. Ген yvmC кодирует циклодипептидсинтазу, и ген сурХ кодирует цитохром Р450 цикло-I-лейцил-I-лейцилдипептидоксидазу.
[199]Таким образом, в дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована таким образом, что по меньшей мере один из генов yvmC и сурХ удален или функционально инактивирован.
[200]Ризобактерия В. subtilis имеет гены для синтеза более чем 20 антибиотиков. Среди них находятся антибиотики-пептиды, такие как лантибиотики и пептиды, подобные лактибиотикам Bacillus subtilis (субтилин, эрицин S, мерсацидин, субланцин 168, субтилозин А) и антибиотики, синтезируемые нерибосомально (пептид) (сурфактин, итуирн, бацилломицин, микосубтилин, коринебактин/бациллибактин, фенгицин, плипастатин, микобациллин, TL-119, бацилизин, бацилизоцин, амикоумацин, 3,3'-неотрегалозадиамин, диффицидин, ризоктицин).
[201]Для получения сиалированного олигосахарида предпочтительно использовать клетку Bacillus, которая не продуцирует антибиотик. Таким образом, в дополнительном и/или альтернативном воплощении клетка Bacillus не синтезирует один или более антибиотиков, выбранных из группы, состоящей из лантибиотиков и пептидов, подобных лантибиотикам, таких как субтилин, эрицин S, мерзацидин, субланцин 168, субтилозин А; антибиотиков, синтезированных нерибосомально (пептид), таких как сурфактин, итурин, бацилломицин, микосубтилин, коринебактин/ бациллибактин, фенгицин, плипастатин, микобациллин, TL-119, бацилизин, бацилизоцин, амикоумацин, 3,3'-неотрегалозадиамин, диффицидин и ризоктицин. Клетка Bacillus могла быть генетически сконструирована для нарушения или аннулирования их своей способности синтезировать один или более из указанных антибиотиков.
[202]Генетически сконструированная клетка Bacillus, которая может продуцировать сиалированный олигосахарид, может, возможно, включать дополнительные признаки и может быть генетически сконструирована для того, чтобы иметь данные дополнительные признаки. Считается, что данные дополнительные признаки улучают продуктивность микроорганизма, который не встречается в природе, приводя к более высоким выходам сиалированного олигосахарида.
[203]Клетка Bacillus по изобретению может продуцировать сиалированный олигосахарид при культивации в присутствии лактозы в среде и в условиях, которые являются пермиссивными в отношении клетки Bacillus, для получения сиалированного олигосахарида. Таким образом, также предложено применение генетически сконструированной клетки Bacillus, как ранее описано в данном документе, для получения сиалированного олигосахарида.
[204]В одном аспекте предложен способ получения сиалированного олигосахарида. Способ включает (i) предоставление клетки Bacillus, как описано ранее в данном документе, (ii) культивацию указанной клетки Bacillus в культуральной среде или ферментационном бульоне и в условиях, которые являются пермиссивными в отношении получения сиалированного олигосахарида. Способ может дополнительно включать извлечение сиалированного олигосахарида из культуральной среды/ферментационного бульона и/или из клетки Bacillus.
[205]Ферментационный бульон содержит по меньшей мере один источник углерода для метаболизма клетки Bacillus. В некоторых воплощениях по меньшей мере один источник углерода выбран из группы, состоящей из глюкозы, фруктозы, сахарозы, глицерина и их комбинаций. Источник углерода может быть поглощен клеткой Bacillus и может быть привлечен метаболизмом клетки Bacillus с образованием биомассы и/или энергии в форме высокоэнергетических трифосфатов.
[206]В некоторых воплощениях ферментационный бульон содержит лактозу, в частности, если клетка Bacillus не может синтезировать лактозу сама по себе. Лактоза может подаваться в ферментационный бульон извне. Лактоза может служить субстратом-акцептором для группировки NeuNAc в получении некоторых сиалированных олигосахаридов, в частности, в получении сиалиллактоз.
[207]В разных воплощениях ферментационный бульон содержит сиаловую кислоту, в частности, если клетка Bacillus используется для получения сиалированного олигосахарида, в которой отсутствует путь биосинтеза сиаловой кислоты, но есть путь утилизации сиаловой кислоты.
[208]В некоторых воплощениях получение сиалированного олигосахарида не требует добавления N-ацетилглюкозамина, N-ацетилманнозамина и/или N-ацетилнейраминовой кислоты в ферментационный бульон и/или культивации генетически сконструированной микробной клетки в присутствии N-ацетилглюкозамина, N-ацетилманнозамина и/или N-ацетилнейрамановой кислоты для внутриклеточного биосинтеза сиалированного олигосахарида, поскольку клетка Bacillus используется для получения сиалированного олигосахарида, в которой имеется путь биосинтеза сиаловой кислоты de novo для внутриклеточного биосинтеза NeuNAC.
[209]В данном способе по меньшей мере одна генетически сконструированная клетка Bacillus культивируется в ферментационном бульоне и в условиях, которые являются пермиссивными в отношении получения сахарида, содержащего по меньшей мере одну группировку N-ацетилнейраминовой кислоты.
[210]В то время как в процессе используется источник углерода в ферментационном бульоне для генетически сконструированной клетки Bacillus, нет необходимости в том, чтобы добавлять глюкозамин и/или N-ацетилнейраминовую кислоту и/или N-ацетилглюкозамин и/или N-ацетилманнозамин в ферментационный бульон, когда клетка Bacillus может внутриклеточно продуцировать N-ацетилнейраминовую кислоту. Таким образом, в разных воплощениях для получения сиалированного олигосахарида, генетически сконструированную клетку Bacillus культивируют в отсутствие и/или без добавления одного или более, выбранных из группы, состоящей из глюкозамина, N-ацетилглюкозамина, N-ацетилманнозамина и N-ацетилнейраминовой кислоты. Генетически сконструированную клетку Bacillus можно культивировать в отсутствии и/или без добавления галактозы, поскольку галактоза не доставляется в качестве субстрата-акцептора для реакции сиалилтрансферазы.
[211]В дополнительных и/или альтернативных воплощениях генетически сконструированную клетку Bacillus культивируют в присутствии одного или более моносахаридов (например, галактозы), дисахаридов (например, лактозы), трисахаридов (например, лакто-N-триозы II), тетрасахаридов (например, лакто-N-тетраозы) и/или пентасахаридов (например, сиалиллакто-N-тетраозы а).
[212]Согласно дополнительному и/или альтернативному воплощению генетически сконструированную клетку Bacillus культивируют в присутствии по меньшей мере одного субстрата-акцептора, выбранного из группы, состоящей из галактозы, N-ацетилгалактозамина, N-ацетилглюкозамина, лактозы, лактулозы, N-ацетиллактозамина, лакто-N-биозы, лакто-N-триозы, 2'-фукозиллактозы, 3-фукозиллактозы, 3'-сиалиллактозы, 6'-сиалиллактозы, 3'-сиалил-N-ацетиллактозамина, 6'-сиалил-N-ацетиллактозамина, 3'-галактозиллактозы, 6'-галактозиллактозы, лакто-N-триозы II, лакто-N-тетраозы, лакто-N-неотетраозы, 2'3-дифукозиллактозы, 3-фукозил-3'-сиалиллактозы и 3-фукозил-6'-сиалиллактозы. Данные субстраты импортируются в клетку и используются в качестве молекул-акцепторов в клетке.
[213]Способ включает возможную стадию выделения сиалированного олигосахарида, который продуцирован генетически сконструированной клеткой Bacillus во время ее культивирования и пролиферации в ферментационном бульоне. Сиалированный олигосахарид может быть выделен из ферментационного бульона после удаления генетически сконструированных клеток Bacillus, например, посредством центрифугирования или фильтрации и/или может быть выделен из клеток, например, в том отношении, что клетки собирают из ферментационного бульона посредством центрифугирования и подвергают стадии лизиса клеток. Затем, сиалированные олигосахариды могут быть дополнительно очищены из ферментационного бульона и/или клеточных лизатов подходящими методиками, известными специалисту в данной области. Подходящие методики включают микрофильтрацию, ультрафильтрацию, диафильтрацию, хроматографию с псевдодвижущимся слоем, электродиализ, обратный осмос, гель-фильтрацию, анионообменную хроматографию, катионообменную хроматографию и т.п.
[214]Способ и генетически сконструированную микробную клетку, которую используют в способе, используют для получения сиалированного олигосахарида. Термин «сиалированный олигосахарид» относится к молекуле олигосахарида, содержащей по меньшей мере одну группировку N-ацетилнейраминовой кислоты.
[215]В дополнительном и/или альтернативном воплощении сиалированный сахарид представляет собой олигосахарид. Термин «олигосахарид», в том виде, в котором он используется в данном документе, относится к полимерам моносахаридных остатков, где указанные полимеры содержат по меньшей мере два моносахаридных остатка, но не больше чем 10 моносахаридных остатков, предпочтительно не больше чем 7 моносахаридных остатков. Олигосахариды представляют собой или линейную цепь моносахаридов или являются разветвленными. Кроме того, моносахаридные остатки олигосахаридов могут характеризоваться целым рядом химических модификаций. Соответственно, олигосахариды могу содержать одну или более несахаридных группировок. Термин «сиалированный олигосахарид», в том виде, в котором он используется в данном документе, относится к олигосахаридам, содержащим один или более группировок N-ацетилнейраминовой кислоты.
[216]Согласно дополнительному и/или альтернативному воплощению сиалированный олигосахарид выбран из группы, состоящей из 3'-сиалиллактозы, 6'-сиалиллактозы, сиалиллакто-N-тетраозы а, сиалиллакто-N-тетраозы b, сиалиллакто-N-тетраозы с, фукозил-сиалиллакто-N-тетраозы а, фукозил-сиалиллакто-N-тетраозы b, фукозил-сиалиллакто-N-тетраозы с, дисиалиллакто-N-тетраозы, фукозиллакто-N-тетраозы I, фукозиллакто-N-тетраозы II, 3'-сиалилгалактозы, 6'-сиалилгалактозы, 3'-сиалил-N-ацетиллактозамина и 6'-сиалил-N-ацетиллактозамина.
[217]В еще одном аспекте изобретения предложено применение генетически сконструированной клетки Bacillus, как описано ранее в данном документе, для получения сиалированного олигосахарида в цельноклеточном ферментационном процессе, а именно, сиалированный олигосахарид синтезируется генетически сконструированной клеткой Bacillus и в генетически сконструированной клетке Bacillus.
[218]В еще одном аспекте изобретения предложен сиалированный олигосахарид, который получен способом и/или посредством применения генетически сконструированной клетки Bacillus, как описано ранее в данном документе.
[219]В еще одном аспекте изобретения предложено применение сиалированного олигосахарида, который получен способом, как описано ранее в данном документе, и/или посредством применения генетически сконструированной клетки Bacillus, как описано ранее в данном документе, для изготовления питательной композиции.
[220]Таким образом, предложена питательная композиция, содержащая по меньшей мере один сиалированный олигосахарид, который получен способом и/или посредством генетически сконструированной клетки Bacillus, как ранее описано в данном документе.
[221]В дополнительном и/или альтернативном воплощении сиалированный олигосахарид выбран из группы, состоящей из 3'-сиалиллактозы, 6'-сиалиллактозы, сиалиллакто-N-тетраозы а, сиалиллакто-N-тетраозы b, сиалиллакто-N-тетраозы с, фукозил-сиалиллакто-N-тетраозы а, фукозил-сиалиллакто-N-тетраозы b, фукозил-сиалиллакто-N-тетраозы с, дисиалиллакто-N-тетраозы, фукозилдисиалиллакто-N-тетраозы I, фукозилдисиаллакто-N-тетраозы II, 3'-сиалилгалактозы, 6'-сиалилгалактозы, 3'-сиалил-N-ацетиллактозамина и 6'-сиалил-N-ацетиллактозамина.
[222]В некоторых воплощениях питательная композиция дополнительно содержит по меньшей мере один нейтральный ОГМ, предпочтительно по меньшей мере один нейтральный ОГМ, который продуцирован посредством использования генетически сконструированной клетки Bacillus. По меньшей мере один нейтральный ОГМ выделен из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, 2',3-дифукозиллактозы, лакто-N-триозы II, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I, лакто-N-неофукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III, лакто-N-фукопентаозы V, лакто-N-неофукопентаозы V, лакто-N-дифукогексаозы I, лакто-N-дифукогексаозы II, лакто-N-неодифукогексаозы I, лакто-N-гексаозы, лакто-N-неогексаозы, пара-лакто-N-гексаозы и пара-лакто-N-неогексаозы.
[223]В дополнительном воплощении питательная композиция выбрана из группы, состоящей из медицинских композиций, фармацевтических композиций, нутрицевтических композиций, детских питательных смесей и биологически активных добавок.
[224]Питательная композиция может быть представлена в жидкой форме или в твердой форме, включая порошки, гранулы, хлопья и пеллеты, но, не ограничиваясь ими.
[225]Настоящее изобретение будет описано относительно конкретных воплощений, но данное изобретение не ограничивается ими, а только формулой изобретения. Кроме того, термины первый, второй и тому подобное в описании и в формуле изобретения используются для проведения различия между похожими элементами и не обязательно для описания последовательности, во времени, в пространстве, по рангу или любым другим образом. Следует понимать, что термины, используемые таким образом, являются взаимозаменяемыми в соответствующих обстоятельствах, и что воплощения изобретения, описанные в данном документе, способны работать в последовательностях, отличных от описанных или проиллюстрированных в данном документе.
[226]Следует отметить, что термин «содержащий», используемый в формуле изобретения, не следует считать ограничивающимся средствами, перечисленными в дальнейшем; он не исключает других элементов или стадий. Таким образом, его следует считать определяющим наличие заявленных признаков, целых чисел, стадий или компонентов, на которые ссылаются, но он не исключает наличие или добавление одного или более других признаков, целых чисел, стадий или компонентов или их групп. Таким образом, объем выражения «устройство, содержащее средства А и В» не следует ограничивать устройствами, состоящими только из компонентов А и В. Оно означает, что в отношении настоящего изобретения, единственными релевантными компонентами устройства являются А и В.
[227]Ссылка на всем протяжении данного описания изобретения на «одно воплощение» или «воплощение» означает, что конкретный признак, структура или характеристика, описанные в связи с данным воплощением, включены в по меньшей мере одно воплощение настоящего изобретения. Таким образом, появления фраз «в одном воплощении» или «в воплощении» в разных местах по всему объему данного описания изобретения не обязательно все относятся к одному и тому же воплощению, но могут. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом, как будет очевидно среднему специалисту в данной области из данного раскрытия, в одном или более воплощениях.
[228]Аналогично, следует понимать, что в описании иллюстративных воплощений изобретения разные признаки изобретения иногда сгруппированы вместе в одном единственном воплощении, фигуре или его описании в целях упрощения раскрытия и помощи в понимании одного или более из разных аспектов изобретения. Данный способ раскрытия, однако, не нужно считать отражающим мысль, что заявленное изобретение требует больше признаков, чем явным образом перечислены в каждом пункте. Скорее, как отражено в приведенной ниже формуле изобретения, аспекты изобретения заключаются меньше чем во всех признаках одного вышеизложенного раскрытого воплощения. Таким образом, формула изобретения после подробного описания явным образом включена тем самым в данное подробное описание, причем каждый пункт отдельно стоит в виде отдельного воплощения данного изобретения.
[229]Кроме того, в то время как некоторые воплощения, описанные в данном документе, включают некоторые, но не все признаки, включенные в другие воплощения, подразумевается, что комбинации признаков разных воплощений находятся в объеме изобретения и образуют разные воплощения, как будет понятно специалистам в данной области. Например, в приведенной ниже формуле изобретения любое из заявленных воплощений можно использовать в любой комбинации.
[230]Кроме того, некоторые из воплощений описаны в данном документе как способ или комбинация элементов способа, которые могут быть реализованы посредством процессора компьютерной системы или с помощью других средств выполнения функции. Таким образом, процессор с необходимыми инструкциями для осуществления такого способа или элемента способа образует средство осуществления способа или элемента способа. Кроме того, описанный в данном документе элемент воплощения аппарата представляет собой пример средства осуществления функции, выполняемой элементом, с целью осуществления изобретения.
[231]В описании и графических материалах, предоставленных в данном документе, изложены многочисленные конкретные подробности. Однако, понятно, что воплощения изобретения можно осуществлять на практике без данных конкретных подробностей. В других примерах хорошо известные способы, структуры и методики не были показаны подробно для того, чтобы не затруднять понимание. Теперь изобретение будет описано с помощью подробного описания нескольких воплощений изобретения. Ясно, что другие воплощения изобретения могут быть скомпонованы в соответствии со знаниями специалистов в данной области, не отклоняясь от истинной сущности или технической идеи изобретения, причем изобретение ограничено только условиями прилагаемой формулы изобретения.
[233]Пример 1: Трансформация Bacillus subtilis
[234]Bacillus subtilis можно подвергать генетическим манипуляциям посредством разных методик. Для трансформации В. subtilis компетентные клетки готовили посредством модифицированного протокола двухстадийного способа (Anagnostopoulos, С.and Spizizen, J. (1961) J Bacteriol 81 (5): 741-746). Ночную культуру инокулировали в среде MG1 и встряхивали при 37°С. Среда MG1 представляет собой минимальную среду Спицайзена, которая дополнена 0,5% глюкозой, 5 мМ MgSO4 и 0,02% казаминовыми кислотами (возможно, дополнительно дополнена биотином и/или L-триптофаном). На следующее утро данную культуру разводили 1:20 в свежей среде MG1 и инкубировали при 37°С в течение приблизительно 6 ч. 1 мл культуры разводили в 8 мл среды MG2, которая отличается от среды MG1 по концентрации казаминовых кислот (0,01% вместо 0,02%). В укороченном протоколе ночную культуру непосредственно разводят в среде MG2. После инкубации в течение еще 90 мин порцию культуры, 1 мл, смешивали с 1-3 мкг мультимерной плазмидной ДНК или линейной ДНК и инкубировали при 37°С в течение 30-60 мин при встряхивании. Мультимерную плазмидную ДНК получали или посредством использования штамма Е. coli NM538 для размножения плазмидной ДНК или посредством линеаризации плазмиды в результате расщепления рестриктазой с одним разрезом, которая осуществляет расщепление в пределах каркаса с последующим повторным лигированием Т4 ДНК лигазой.
[235]Затем, клетки распределяли по чашкам с 2xYT и агаром, содержащим соответствующий антибиотик. Антибиотики добавляли в следующих концентрациях: 5 мкг⋅мл-1 эритромицина, 5 мкг⋅мл-1 хлорамфеникола, 10 мкг⋅мл-1 канамицина. 100 мкг⋅мл-1 спектиномицина.
[236]В качестве альтернативы, для трансформации протопластов (Romero, D. et al. (2006) Journal of Microbiological Methods 66:556-559) клетки выращивали в 20 мл бульона Penassay (РАВ) при 37°С до начала стационарной фазы роста (OD600 (от англ. optical density - оптическая фаза) равна 1,7-2). Затем клетки осаждали и ресуспендировали в 10 мл среды SMPP (0,3%-ный бычий сывороточный альбумин, 5%-ная 2 М сахароза, 25% 4× РАВ, 50% 2× SMM), состоящей из 2×SMM, представляющего собой 1 М сахарозу, 0,04 М гидрат двунатриевой соли малеиновой кислоты и 0,04 М MgCl2 (рН 6,5). После добавления лизоцима (10 мг мл-1) и мутанолизина (75 Ед мл-1) смесь инкубировали при 37°С при встряхивании с образованием протопластов. Образование протопластов проверяли посредством микроскопа. Затем протопласты аккуратно собирали посредством центрифугирования при 5200 ×g и 4°С в течение 5 мин, два раза промывали охлажденным льдом промывочным буфером для электротрансформации (1× SMM) и, в конечном итоге, суспендировали в данном растворе. Плазмидную ДНК (1-3 мкг) добавляли к 120 мкл суспензии протопластов, и смесь держали на льду в течение по меньшей мере 5 мин. Смесь для трансформации переносили в кювету, объемом 0,2 см, и один импульс для электропорации прикладывали на уровне 25 мкФ, 400 Ω⋅ и 0,7 кВ. Сразу после разряда электропорации 1 мл восстанавливающей среды (равные объемы 4х РАВ и 2х SMM, свежеприготовленные перед применением) добавляли в кювету. Затем реакционную смесь для трансформации переносили в 2 мл пробирку и инкубировали при 37°С при встряхивании в течение 12 ч. Для регенерации клеточную суспензию распределяли по чашкам с DM3 и агаром (Chang, S. and Cohen, S. (1979) MGG 168(1):111-115) и инкубировали при 37°C в течение 48 ч. Регенерирующая среда DM3 содержала следующие стерильные растворы на литр: 200 мл 4%-ого агара, 100 мл 5%-ных казаминовых кислот, 50 мл 10%-ого дрожжевого экстракта, 100 мл 3,5%-ого K2HPO4 и 1,5%-ого KH2PO4, 25 мл 20%-ной глюкозы, 20 мл 1 М MgCl2, 500 мл 0,5 М сорбита и 5 мл стерилизованного посредством фильтрации 2%-ого бычьего сывороточного альбумина (добавляемые к смеси, когда температура ниже 55°С), и ее дополняли соответствующим антибиотиком.
[237]Электропорацию В. subtilis проводили в соответствии с модифицированным протоколом от Zhang et al. (2011), предоставленным MoBiTec GmbH (Zhang.G., Bao,P., Zhang,Y., Deng,A., Chen,N. и Wen,T. (2011) Anal. Biochem., 409:130-137). Ночную культуру 2x YT разводили в 100 раз свежей средой 2х YT, и культуру выращивали до OD600 0,2 при 37°С на ротационной качалке. Затем культуру дополняли 1%-ным DL-треонином, 2%-ным глицином, 0,1%-ным триптофаном и 0,03% Tween 80. После культивирования в течение еще 60 мин клеточную суспензию охлаждали на льду в течение 20 мин, центрифугировали при 5000 × g в течение 10 мин при 4°С и два раза промывали буфером для электропорации (0,5 М трегалоза, 0,5 М сорбит, 0,5 М маннит, 0,5 мМ MgCl2, 0,5 мМ K2HPO4, 0,5 мМ KH2PO4, рН 7,4, стерилизовали посредством фильтрации и хранили в замороженном виде). Наконец, клетки ресуспендировали в буфере для электропорации в соотношении 1/100 исходного объема культуры, и 100 мкл клеточной суспензии смешивали с ДНК. Смесь для трансформации переносили в 0,1-см кювету, и электропорацию проводили при 1,8 кВ с помощью одного импульса, доставляемого посредством прибора MicroPulser™ (Bio-Rad). Сразу после доставки импульса 1 мл бульона 2х YT, содержащего 0,5 М сорбит и 0,38 М маннит, добавляли в кювету. Суспензию для трансформации переносили в пробирку, объемом 2 мл, и инкубировали при 37°С в течение 3 ч на ротационной качалке. Клетки распределяли по чашке с 2х YT и агаром и инкубировали при 37°С в течение ночи.
[238]Используя альтернативный протокол электропорации (Xue, G.P., J.S. Johnson and В.P. Dalrymple: 1999; Journal of Microbiological Methods 34:183-191), 5 мл седы LB, содержащей 0,5 M глюцит, инокулировали В. subtilis и инкубировали в течение ночи при 37°С.Далее, ночную культуру разводили (1:16) 75 мл LB, содержащей 0,5 М глюцит, и инкубировали до получения OD600 0,85-0,95. Затем клетки осаждали посредством центрифугирования в течение 10 мин при 4°С при 5,000хg и четыре раза промывали буфером для электропорации, охлажденным посредством льда (10% глицерин, 0,5 М глюцит, 0,5 М маннит). Наконец, клетки ресуспендировали в 1-2 мл буфера для электропорации. Электропорацию проводили, используя 60 мкл компетентных клеток с ДНК в охлажденной кювете для электропорации (расстояние между электродами 1 мм). Смесь клетки-ДНК подвергали воздействию одного электрического импульса на уровне 25 мкФ, 200 Ω и 21 кВ/см. Наконец, 1 мл бульона для восстановления (LB, содержащая 0,5 М глюцит и 0,38 М маннит) добавляли к электропермеабилизированным клеткам, и бактериальную культуру инкубировали в течение 3 ч при 37°С с последующим посевом на LB с агаром с добавлением антибиотика.
[239]Использовали две разные обогащенные среды, а именно бульон Luria (LB) и 2х YT.
[240]Среда бульон Luria (LB) состояла из 1%-ого триптона, 0,5%-ого дрожжевого экстракта и 0,5% NaCl (рН 7,2).
[241]Среда 2х YT состояла из 1,6%-ого триптона, 1%-ого дрожжевого экстракта и 0,5% NaCl (рН 7,5).
[242]Для получения чашек с обогащенной средой с агаром добавляли 15 г л-1 агара.
[243]Для экспериментов со встряхиваемыми колбами использовали минимальную среду Спицайзена (Spizizen, J. 1958 Proc. Natl. Acad. Sci. U. S. A. 44(10):1072-1078).
[244]Минимальная среда Спицайзена содержит следующие соли: 2 г/л (NH4)2SO4, 14 г/л K2HPO4, 6 г/л KH2PO4, 1 г/л цитрата Na3 × 2⋅H2O и 0,2 г/л MgSO4 × 7⋅H2O.
[245]Предкультуральная среда, состоящая из минимальных солей Спицайзена, дополненная 2% D-глюкозой, 0,05% казаминовыми кислотами и MgSO4, до конечной концентрации 2 мМ (возможно дополнительно дополненная биотином и/или L-триптофаном).
[246]Основная культуральная среда состояла из минимальных солей Спицайзена, дополненная 2%-ной D-глюкозой, 0,05%-ными казаминовыми кислотами, MgSO4 до конечной концентрации 2 мМ и 0,5 мл⋅л-1 1000х раствора микроэлементов (возможно дополнительно дополненная биотином и/или L-триптофаном).
[247]Раствор микроэлементов (1000х) состоял из 100,6 г л-1 C6H9NO6, 56,4 г⋅л-1цитрата железа (III)-аммония, 9,8 г⋅л-1 MnCl2 × 4⋅H2O, 1,6 г⋅л-1 CoCl2 × 6⋅H2O, 1 г⋅л-1CuCl2 × 2⋅H2O, 1,9 г⋅л-1 Н3BO3, 9 г⋅л-1 ZnSO4 × 7⋅H2O, 1,1 г⋅л-1 Na2MoO4 × 2⋅H2O, 1,5 г⋅л-1 Na2SeO3, 1,5 г⋅л-1 NiSO4 × 6⋅H2O.
[248]При необходимости, соответствующий(ие) антибиотик(и) добавляли к среде для того, чтобы сделать ее селективной.
[249]Штаммы В. subtilis исходно выращивали на чашках с обогащенными средами с агаром с получением одиночных колоний. Данные чашки выращивали в течение 1 суток при 30-37°С. В экспериментах со встряхиваемыми колбами 20 мл предварительной культуры инокулировали одиночной колонией и выращивали в течение ночи при 30-37°С на ротационной качалке. Следующие 20 мл основных культур инокулировали данной предварительной культурой до начальной OD600примерно 0,1 и инкубировали при 30-37°С на ротационной качалке. Если требовалась индукция, 40-60 мл основной культуры разбивали на порции по 20 мл в момент времени индукции. Объем культуры не превышал 20% емкости встряхиваемой колбы.
[250]Пример 2: Конструирование штамма-продуцента Bacillus subtilis для 3'-сиалиллактозы
[251]Для синтеза 3'-сиалиллактозы из метаболического промежуточного соединения - УДФ-N-ацетилглюкозамина с использованием пути neuCBA, конструировали экспрессионную плазмиду В. subtilis (SEQ ID NO: 1). Сначала гены neuA, neuB, neuC, а также α-2,3-сиалилтрансферазу, подвергали оптимизации кодонов для экспрессии в В. subtilis и получали синтетически посредством GenScript Corp.Ген neuA Campylobacter jejuni (номер доступа UniProtKB: Q93MP7) кодирует синтетазу CMP-Neu5Ac. Ген neuB Campylobacter jejuni (номер доступа UniProtKB: Q93MP9) кодирует синтазу сиаловой кислоты. Ген neuC Campylobacter jejuni (номер доступа UniProtKB: Q93MP8) кодирует N-ацетилглюкозамин-6-фосфат 2-эпимеразу. Ген siaT Pasteurella multocida (номер доступа UniProtKB: Q9CLP3) кодирует α-2,3-сиалилтрансферазу. Открытую рамку считывания гена lacY Е. coli (номе доступа Gen Bank: NP_414877.1), кодирующую лактозопермеазу, амплифицировали посредством ПЦР (полимеразная цепная реакция) из хромосомной ДНК. Затем, конструировали экспрессионную кассету <Pgrac100-neuBCA-siaT-lacY-terminator>, которая содержит все необходимые гены под контролем индуцибельного промотора Pgrac100. С этой целью, экспрессионный вектор рНТ253 В. subtilis (MoBiTec GmbH, Göttingen, Германия) использовали в качестве каркаса. Каждый ген в пределах экспрессионной кассеты связывали с последовательностью RBS В. subtilis. Дополнительно, подходящую терминирующую последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) помещали ниже экспрессионной кассеты. Полученную плазмиду <pHT253-Pgrac100-neuBCA-2,3siaT-lacY-terminator> (SEQ ID NO: 1) использовали для трансформации спорообразующего штамма В. subtilis (таблица 1) посредством использования его природной компетентности.
[252]Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени.
[253]Трансформанты культивировали в условиях, которые являются пермиссивными в отношении В. subtilis, с получением 3'-сиалиллактозы в присутствии экзогенной лактозы.
[254]Пример 3: Конструирование штамма-продуцента Bacillus subtilis для 3'-сиалиллактозы
[255]Для синтеза 3'-сиалиллактозы из метаболического промежуточного соединения - УДФ-N-ацетилглюкозамина с использованием пути neuCBA, конструировали конститутивную экспрессионную плазмиду В. subtilis (SEQ ID NO: 2). Сначала, гены neuA, neuB, neuC и siaT подвергали оптимизации кодонов для экспрессии в В. subtilis и получали синтетически посредством GenScript Corp.Ген neuA Campylobacter jejuni (номер доступа UniProtKB: Q93MP7) кодирует синтетазу CMP-Neu5Ac. Ген neuB Campylobacter jejuni (номер доступа UniProtKB: Q93MP9) кодирует синтазу сиаловой кислоты.
[256]Ген neuC Campylobacter jejuni (номер доступа UniProtKB: Q93MP8) кодирует N-ацетилглюкозамин-6-фосфат 2-эпимеразу. Ген siaT Pasteurella multocida (номер доступа UniProtKB: Q9CLP3) кодирует α-2,3-сиалилтрансферазу. Открытую рамку считывания гена lacY Е. coli (номе доступа Gen Bank: NP_414877.1), кодирующую лактозопермеазу, амплифицировали посредством ПЦР из хромосомной ДНК. Затем, конструировали экспрессионную кассету <P43-neuBCA-PlepA-siaT-lacY-terminator>, которая содержит все необходимые гены, функционально связанные с двумя сильными конститутивными промоторами В. subtilis  и/или Р43. Экспрессионный вектор рНТ253 В. subtilis (MoBiTec GmbH, Göttingen, Германия) использовали в качестве каркаса плазмиды. Каждый ген в пределах экспрессионной кассеты был связан с последовательностью RBS В. subtilis. Дополнительно, подходящую терминирующую последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) помещали ниже экспрессионной кассеты.
и/или Р43. Экспрессионный вектор рНТ253 В. subtilis (MoBiTec GmbH, Göttingen, Германия) использовали в качестве каркаса плазмиды. Каждый ген в пределах экспрессионной кассеты был связан с последовательностью RBS В. subtilis. Дополнительно, подходящую терминирующую последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) помещали ниже экспрессионной кассеты.
[257]Полученную плазмиду <phT253-P43-neuBCA- -siaT-lacY-terminator> (SEQ ID NO: 2) использовали для трансформации спорообразующего и неспорообразующего штаммов В. subtilis (таблица 1) посредством использования их природной компетентности.
-siaT-lacY-terminator> (SEQ ID NO: 2) использовали для трансформации спорообразующего и неспорообразующего штаммов В. subtilis (таблица 1) посредством использования их природной компетентности.
[258]Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени.
[259]Трансформанты культивировали в условиях, которые являются пермиссивными в отношении В. subtilis, с получением 3'-сиалиллактозы в присутствии экзогенной лактозы.
[260]Пример 4: Конструирование штамма-продуцента Bacillus subtilis для 6'-сиалиллактозы
[261]Для продукции 6'-сиалиллактозы в В. subtilis использовали α-2,6-сиалилтрансферазу из Photobacterium leiognathi. Открытую рамку считывания гена siaT (номер доступа UniProtKB: D0VYB7) подвергали оптимизации кодонов для экспрессии в В. subtilis и получали синтетически посредством GenScript Corp.
[262]Экспрессионную плазмиду <pHT253-Pgrac100-neuBCA-2,6siaT-lacY-terminator> (SEQ ID NO: 3) конструировали, как описано в примере 2. Полученную плазмиду (SEQ ID NO: 3) использовали для трансформации спорообразующего и неспорообразующего штаммов В. subtilis (Таблица 1) посредством использования их природной компетентности. Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени. Трансформанты культивировали в условиях, которые являются пермиссивными в отношении В. subtilis, с получением 6'-сиалиллактозы в присутствии экзогенной лактозы.
[263]Пример 5: Конструирование штамма Bacillus subtilis для получения 3'-сиалиллактозы
[264]Конструирование метаболизма В. subtilis (Таблица 1) достигалось посредством интеграции гетерологичных генов neuA Campylobacter jejuni, nanT Е. coli и siaT Haemophilus parahaemolyticus и одновременного удаления эндогенного гена ganA посредством гомологичной рекомбинации. Ген ganA В. subtilis (yvfN, lacA), который расположен в пределах галактозного оперона, кодирует бета-галактозидазу.
[265]Для продукции 3'-сиалиллактозы из экзогенной сиаловой кислоты/N-ацетилнейраминовой кислоты и лактозы, открытые рамки считывания neuA, nanT и siaT были функционально связаны с конститутивным промотором Р43 В. subtilis (часть репозитория iGem: ID последовательности: ВВа_K143013) в виде оперона. С этой целью, во-первых, гены neuA, nanT и siaT подвергали оптимизации кодонов для экспрессиии в В. subtilis и получали синтетически посредством GenScript Corp.Ген neuA Campylobacter jejuni (номер доступа UniProtKB: Q93MP7) кодирует синтетазу CMP-Neu5Ac, ген nanT Е. coli (номер доступа GenBank: NP_417691.4) кодирует транспортер сиаловой кислоты и ген siaT Н. parahaemolyticus (номер доступа UniProtKB: I3DHL4) кодирует альфа-N-ацетилнейраминил-2,3-бета-галактозил-1,3-N-ацетилгалактозаминид 6-альфа-сиалилтрансферазу (альфа-2,3-сиалилтрансферазу).
[266]Каждый ген в пределах экспрессионной кассеты был связан с последовательностью RBS В. subtilis. Кроме того, подходящая терминирующая последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) была расположена ниже экспрессионной кассеты.
[267]Клонирующий вектор pBR322 (New England Biolabs GmbH, Франкфурт, Германия) использовали в качестве каркаса плазмиды. Кассету полной интеграции собирали для создания суицидной плазмиды<pBR322 flank ganA up-Р43-siaT-neuA-nanT-terminator-erm-flank ganA down>(SEQ ID NO: 4). Затем, В. subtilis трансформировали данной плазмидой за счет ее природной компетентности. Клетки распределяли по чашкам с 2х YT и агаром, содержащей соответствующий антибиотик (5 мкг мл-1 эритромицина). Интеграцию экспрессионной кассеты <Р43-siaT-neuA-nanT-terminator> в локус ganA генома В. subtilis, с получением штамма А, проверяли посредством ПЦР на колониях. Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени.
[268]Для импортирования экзогенной лактозы в клетку Bacillus ген lacY Е. coli интегрировали в эндогенный локус amyE (amyA) генома В. subtilis (кодирующий альфа-амилазу). С этой целью, открытую рамку считывания гена lacY Е. coli (номер доступа Gen Bank: NP_414877.1), кодирующую лактозопермеазу, амплифицировали посредством ПЦР из хромосомной ДНК. Кассету интеграции <flank amyE up-1ох71-aad9-lox66-P43-lacY-flank amyE down> (SEQ ID NO: 5) конструировали и клонировали в pBR322 (New England Biolabs GmbH, Фанкфурт, Германия). Штамм A трансформировали полученной суицидной плазмидой за счет природной компетентности. Интеграцию экспрессионной кассеты <Р43-lacY> в локус amyE штамма А, с получением конечного штамма В проверяли посредством ПЦР на колониях.
[269]Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени. Штамм В культивировали в условиях, которые являются пермиссивными в отношении В. subtilis с получением 3'-сиалиллактозы в присутствии экзогенной лактозы и сиаловой кислоты/N-ацетилнейраминовой кислоты.
[270]Пример 6: Получение сиалиллактозы с использованием штаммов Bacillus subtilis с модифицированным метаболизмом
[271]Предварительную культуру инокулировали штаммом Bacillus subtilis с модифицированным метаболизмом, подходящим для биосинтеза сиалиллактозы (как описано в примерах 2-5).
[272]Предварительную культуру инкубировали при 30-37°С в течение ночи и затем разводили до исходной OD600 примерно 0,1 в свежей основной культуральной среде. Когда основная культура достигала OD600 приблизительно 0,5, 2 мМ лактозу добавляли к среде для выращивания. Когда для экспрессии гена использовали индуцибельный промотор Pgrac100, индукцию осуществляли посредством лактозы (2 мМ) или как лактозы (2 мМ), так и IPTG (от англ. isopropylthiogalactoside -изопропилтиогалактозид) (1 мМ). Для утилизирующего биосинтеза CMP-N-ацетилнейраминовой кислоты, дополнительно, добавляли 2 мМ сиаловой кислоты/N-ацетилнейраминовой кислоты. Культивирование прекращали после примерно 24 ч/48 ч после индукции, и внутриклеточную и внеклеточную сиалиллактозу анализировали посредством тонкослойной хроматографии и/или ВЭЖХ (высокоэффективной жидкостной хроматографии) и/или масс-спектрометрии (как описано в WO 2017/042382 А или WO 2019/008133 А). Выявляли биосинтез существенных количеств сиалиллактозы (3'-сиалиллактозы/6'-сиалиллактозы).
[274] ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[275]<110> Jennewein Biotechnologie GmbH
[276]<120> ПРОДУКЦИЯ СИАЛИРОВАННЫХ ОЛИГОСАХАРИДОВ В КЛЕТКАХ BACILLUS
[279]<170> PatentIn version 3.5
[283]<213> Искусственная последовательность
[285]<223> Экспрессионная плазмида
[287]ttaagttatt ggtatgactg gttttaagcg caaaaaaagt tgctttttcg tacctattaa
[289]tgtatcgttt tagaaaaccg actgtaaaaa gtacagtcgg cattatctca tattataaaa
[291]gccagtcatt aggcctatct gacaattcct gaatagagtt cataaacaat cctgcatgat
[293]aaccatcaca aacagaatga tgtacctgta aagatagcgg taaatatatt gaattacctt
[295]tattaatgaa ttttcctgct gtaataatgg gtagaaggta attactatta ttattgatat
[297]ttaagttaaa cccagtaaat gaagtccatg gaataataga aagagaaaaa gcattttcag
[299]gtataggtgt tttgggaaac aatttccccg aaccattata tttctctaca tcagaaaggt
[301]ataaatcata aaactctttg aagtcattct ttacaggagt ccaaatacca gagaatgttt
[303]tagatacacc atcaaaaatt gtataaagtg gctctaactt atcccaataa cctaactctc
[305]cgtcgctatt gtaaccagtt ctaaaagctg tatttgagtt tatcaccctt gtcactaaga
[307]aaataaatgc agggtaaaat ttatatcctt cttgttttat gtttcggtat aaaacactaa
[309]tatcaatttc tgtggttata ctaaaagtcg tttgttggtt caaataatga ttaaatatct
[311]cttttctctt ccaattgtct aaatcaattt tattaaagtt catttgatat gcctcctaaa
[313]tttttatcta aagtgaattt aggaggctta cttgtctgct ttcttcatta gaatcaatcc
[315]ttttttaaaa gtcaatatta ctgtaacata aatatatatt ttaaaaatat cccactttat
[317]ccaattttcg tttgttgaac taatgggtgc tttagttgaa gaataaagac cacattaaaa
[319]aatgtggtct tttgtgtttt tttaaaggat ttgagcgtag cgaaaaatcc ttttctttct
[321]tatcttgata ataagggtaa ctattgccga tcgtccattc cgacagcatc gccagtcact
[323]atggcgtgct gctagcgcca ttcgccattc aggctgcgca actgttggga agggcgatcg
[325]gtgcgggcct cttcgctatt acgccagctg gcgaaagggg gatgtgctgc aaggcgatta
[327]agttgggtaa cgccagggtt ttcccagtca cgacgttgta aaacgacggc cagtgaattc
[329]gagctcaggc cttaactcac attaattgcg ttgcgctcac tgcccgcttt ccagtcggga
[331]aacctgtcgt gccagctgca ttaatgaatc ggccaacgcg cggggagagg cggtttgcgt
[333]attgggcgcc agggtggttt ttcttttcac cagtgagacg ggcaacagct gattgccctt
[335]caccgcctgg ccctgagaga gttgcagcaa gcggtccacg ctggtttgcc ccagcaggcg
[337]aaaatcctgt ttgatggtgg ttgacggcgg gatataacat gagctgtctt cggtatcgtc
[339]gtatcccact accgagatat ccgcaccaac gcgcagcccg gactcggtaa tggcgcgcat
[341]tgcgcccagc gccatctgat cgttggcaac cagcatcgca gtgggaacga tgccctcatt
[343]cagcatttgc atggtttgtt gaaaaccgga catggcactc cagtcgcctt cccgttccgc
[345]tatcggctga atttgattgc gagtgagata tttatgccag ccagccagac gcagacgcgc
[347]cgagacagaa cttaatgggc ccgctaacag cgcgatttgc tggtgaccca atgcgaccag
[349]atgctccacg cccagtcgcg taccgtcttc atgggagaaa ataatactgt tgatgggtgt
[351]ctggtcagag acatcaagaa ataacgccgg aacattagtg caggcagctt ccacagcaat
[353]ggcatcctgg tcatccagcg gatagttaat gatcagccca ctgacgcgtt gcgcgagaag
[355]attgtgcacc gccgctttac aggcttcgac gccgcttcgt tctaccatcg acaccaccac
[357]gctggcaccc agttgatcgg cgcgagattt aatcgccgcg acaatttgcg acggcgcgtg
[359]cagggccaga ctggaggtgg caacgccaat cagcaacgac tgtttgcccg ccagttgttg
[361]tgccacgcgg ttgggaatgt aattcagctc cgccatcgcc gcttccactt tttcccgcgt
[363]tttcgcagaa acgtggctgg cctggttcac cacgcgggaa acggtctgat aagagacacc
[365]ggcatactct gcgacatcgt ataacgttac tggtttcatc aaaatcgtct ccctccgttt
[367]gaatatttga ttgatcgtaa ccagatgaag cactctttcc actatcccta cagtgttatg
[369]gcttgaacaa tcacgaaaca ataattggta cgtacgatct ttcagccgac tcaaacatca
[371]aatcttacaa atgtagtctt tgaaagtatt acatatgtaa gatttaaatg caaccgtttt
[373]ttcggaagga aatgatgacc tcgtttccac cggaattagc ttggtaccaa aggaggtaag
[375]gatcactaga aaatttttta aaaaatctct tgacattgga agggagatat gttattataa
[377]gaattgcgga attgtgagcg gataacaatt cccatataga ttaactaata aggaggacaa
[379]acatgaaaga aatcaaaatc caaaacatca tcatcagcga agaaaaagcg ccgctggttg
[381]tgccggaaat cggcattaat cataacggat ctttagaact ggctaaaatc atggttgatg
[383]cagcgttttc agctggagcc aaaatcatca aacatcaaac acatatcgtc gaagatgaaa
[385]tgagcaaagc tgcaaagaaa gttatcccgg gcaacgctaa aatctctatc tacgaaatca
[387]tgcagaaatg cgctttagat tacaaagatg aacttgccct gaaagaatac acagaaaaac
[389]tgggacttgt gtatcttagc acaccgtttt caagagcagg cgcgaatcgc ttagaagata
[391]tgggagtctc tgcatttaaa atcggctcag gagaatgtaa taactatccg ctgatcaaac
[393]atattgcagc gtttaaaaaa ccgatgattg tgtctacagg catgaactca atcgaaagca
[395]ttaaaccgac agtgaaaatc ctgcttgata acgaaatccc gtttgtcctg atgcatacaa
[397]caaacctgta tccgacaccg cataatcttg ttagattaaa cgccatgctg gaactgaaga
[399]aagaatttag ctgcatggtg ggactttctg atcatacaac agataatctg gcatgccttg
[401]gcgcggtcgt tcttggagcg tgtgtcttag aaagacattt tacagattca atgcatcgca
[403]gcggaccgga tattgtttgt tctatggata caaaagcctt aaaagaactg atcattcaat
[405]cagaacagat ggcaatcatt cgcggcaata acgaatcaaa gaaagcagcc aaacaagaac
[407]aggttacaat cgattttgct tttgcctctg tggtctcaat caaagatatt aagaaaggcg
[409]aagttctgtc aatggataat atttgggtga aaagaccggg acttggcgga atcagcgcag
[411]cggaatttga aaatattctg ggcaagaaag cactgcgcga tattgaaaac gatgcgcagt
[413]taagctatga agattttgct taagctctta aggaggattt tagaatgaag aaaattctgt
[415]ttatcacagg ctcaagagcg gattactcta aaatcaaatc acttatgtac cgcgtccaaa
[417]attcaagcga atttgaactt tacatctttg ctacaggcat gcatctgagc aaaaactttg
[419]gatacacagt taaagaatta tataaaaatg gctttaaaaa catctacgaa tttatcaact
[421]acgataaata ttatcagaca gataaagccc tggcaacaac aattgatgga ttttcaagat
[423]atgcgaacga attaaaaccg gatctgattg ttgtgcatgg cgatcgcatc gaaccgcttg
[425]cagcggctat tgtcggagcc cttaacaaca tcctggttgc acatatcgaa ggcggagaaa
[427]ttagcggaac aatcgatgat tctttaagac atgcgatttc aaaacttgct catatccatc
[429]tggtgaacga tgaatttgca aaaagacgcc ttatgcaatt aggcgaagat gaaaaatcaa
[431]tctttatcat cggatctccg gatctggaac tgcttaacga taacaaaatc tcacttagcg
[433]aagccaaaaa atactacgat attaactacg aaaactatgc attactgatg tttcatccgg
[435]tcacaacaga aatcacatct atcaaaaacc aagccgataa cctggtgaaa gcacttatcc
[437]agtcaaacaa aaactacatc gtcatctatc cgaataacga tctgggcttt gaactgatcc
[439]ttcagagcta tgaagaattt aaaaacaacc cgagatttaa actgtttccg tctctgcgct
[441]ttgaatactt tatcacactt ctgaaaaacg ccgattttat tatcggaaac tcttcatgca
[443]tcctgaaaga agcgttatac ctgaaaacag ctggcattct ggttggatca agacaaaatg
[445]gccgcttagg aaatgaaaac acactgaaag tgaatgcgaa cagcgatgaa atccttaaag
[447]ctatcaacac aatccataaa aaacaggatt tattttctgc taaactggaa attcttgata
[449]gctctaaact gtttttcgaa tatcttcaat caggcgattt ctttaaactt agcacacaga
[451]aagtttttaa agatattaaa taaaaaggag gaactactat gtcacttgca attatcccgg
[453]cgagaggcgg aagcaaaggc atcaaaaaca aaaacctggt tctgcttaac aacaaaccgc
[455]ttatctacta cacaatcaaa gcagcgctga atgctaaatc tatttcaaaa gttgtggtct
[457]caagcgatag cgatgaaatc cttaactacg ccaaatctca aaacgtggat attctgaaaa
[459]gaccgatctc tcttgcacag gatgatacaa catcagataa agtcttactg catgcgctga
[461]aattttacaa agattacgaa gatgttgtgt ttttacaacc gacatctccg ctgcgcacaa
[463]acattcatat caacgaagca tttaacctgt acaaaaattc aaacgctaat gccctgatta
[465]gcgtctctga atgcgataac aaaatcctta aagcatttgt ttgcaacgat tgtggcgatt
[467]tagccggaat ttgtaatgat gaatatccgt ttatgccgcg ccagaaactg ccgaaaacat
[469]atatgagcaa cggagcgatc tacatcctta aaatcaaaga atttctgaac aacccgtcat
[471]ttctgcaaag caaaacaaaa cattttctta tggatgaatc atcatcactg gatattgatt
[473]gcctggaaga tttaaagaaa gttgaacaaa tttggaaaaa ataaagatta actaataagg
[475]aggacaaaca tggataaatt tgctgaacat gaaattccga aagctgttat cgtggccggc
[477]aacggagaat ctctttcaca aatcgattac agactgcttc cgaaaaacta tgatgtcttt
[479]agatgcaacc agttttactt tgaagaacgc tattttcttg gcaacaaaat caaagcagtt
[481]ttctttacac cgggagtgtt tttagaacaa tactacacac tgtaccatct taaacgcaac
[483]aacgaatact ttgtcgataa cgttatcctg tcatcattta accatccgac agttgatctg
[485]gaaaaatcac aaaaaatcca ggctctgttt attgatgtga tcaacggcta cgaaaaatac
[487]ctgtctaaac tgacagcctt tgatgtttat ctgagataca aagaacttta cgaaaaccaa
[489]cgcattacat caggagtgta tatgtgcgcc gtcgcaatcg cgatgggcta tacagatatt
[491]taccttacag gaatcgattt ttatcaggca agcgaagaaa actacgcgtt tgataacaaa
[493]aaaccgaaca tcatcagatt actgccggat tttcgcaaag aaaaaacatt attttcatat
[495]catagcaaag atattgatct tgaagcatta tcttttctgc aacagcatta ccatgttaac
[497]ttttacagca tttctccgat gtctccgctg tcaaaacatt ttccgatccc gacagtggaa
[499]gatgattgtg aaacaacatt tgtcgcgccg ctgaaagaaa actacatcaa cgatattctt
[501]ttaccgccgc attttgtcta tgaaaaactt ggcgttgata aacttgcagc ggctttagaa
[503]catcatcatc atcatcatta aagtgatagc ggtaccatta taggtaagag aggaatgtac
[505]acatgtacta tttaaaaaac acaaactttt ggatgttcgg tttattcttt ttcttttact
[507]tttttatcat gggagcctac ttcccgtttt tcccgatttg gctacatgac atcaaccata
[509]tcagcaaaag tgatacgggt attatttttg ccgctatttc tctgttctcg ctattattcc
[511]aaccgctgtt tggtctgctt tctgacaaac tcgggctgcg caaatacctg ctgtggatta
[513]ttaccggcat gttagtgatg tttgcgccgt tctttatttt tatcttcggg ccactgttac
[515]aatacaacat tttagtagga tcgattgttg gtggtattta tctaggcttt tgttttaacg
[517]ccggtgcgcc agcagtagag gcatttattg agaaagtcag ccgtcgcagt aatttcgaat
[519]ttggtcgcgc gcggatgttt ggctgtgttg gctgggcgct gtgtgcctcg attgtcggca
[521]tcatgttcac catcaataat cagtttgttt tctggctggg ctctggctgt gcactcatcc
[523]tcgccgtttt actctttttc gccaaaacgg atgcgccctc ttctgccacg gttgccaatg
[525]cggtaggtgc caaccattcg gcatttagcc ttaagctggc actggaactg ttcagacagc
[527]caaaactgtg gtttttgtca ctgtatgtta ttggcgtttc ctgcacctac gatgtttttg
[529]accaacagtt tgctaatttc tttacttcgt tctttgctac cggtgaacag ggtacgcggg
[531]tatttggcta cgtaacgaca atgggcgaat tacttaacgc ctcgattatg ttctttgcgc
[533]cactgatcat taatcgcatc ggtgggaaaa acgccctgct gctggctggc actattatgt
[535]ctgtacgtat tattggctca tcgttcgcca cctcagcgct ggaagtggtt attctgaaaa
[537]cgctgcatat gtttgaagta ccgttcctgc tggtgggctg ctttaaatat attaccagcc
[539]agtttgaagt gcgtttttca gcgacgattt atctggtctg tttctgcttc tttaagcaac
[541]tggcgatgat ttttatgtct gtactggcgg gcaatatgta tgaaagcatc ggtttccagg
[543]gcgcttatct ggtgctgggt ctggtggcgc tgggcttcac cttaatttcc gtgttcacgc
[545]ttagcggccc cggcccgctt tccctgctgc gtcgtcaggt gaatgaagtc gcttaaggat
[547]ccatgtctag agtcgacgtc cccggggcag cccgcctaat gagcgggctt ttttcacgtc
[549]ccaggcatca aataaaacga aaggctcagt cgaaagactg ggcctttcgt tttatctgtt
[551]gtttgtcggt gaacgctctc tactagagtc acactggctc accttcgggt gggcctttct
[553]gcgtttatac ccggggcagc ccgcctaatg agcgggcttt tttcacgtca cgcgtccatg
[555]gagatctttg tctgcaactg aaaagtttat accttacctg gaacaaatgg ttgaaacata
[557]cgaggctaat atcggcttat taggaatagt ccctgtacta ataaaatcag gtggatcagt
[559]tgatcagtat attttggacg aagctcggaa agaatttgga gatgacttgc ttaattccac
[561]aattaaatta agggaaagaa taaagcgatt tgatgttcaa ggaatcacgg aagaagatac
[563]tcatgataaa gaagctctaa aactattcaa taaccttaca atggaattga tcgaaagggt
[565]ggaaggttaa tggtacgaaa attaggggat ctacctagaa agccacaagg cgataggtca
[567]agcttaaaga acccttacat ggatcttaca gattctgaaa gtaaagaaac aacagaggtt
[569]aaacaaacag aaccaaaaag aaaaaaagca ttgttgaaaa caatgaaagt tgatgtttca
[571]atccataata agattaaatc gctgcacgaa attctggcag catccgaagg gaattcatat
[573]tacttagagg atactattga gagagctatt gataagatgg ttgagacatt acctgagagc
[575]caaaaaactt tttatgaata tgaattaaaa aaaagaacca acaaaggctg agacagactc
[577]caaacgagtc tgttttttta aaaaaaatat taggagcatt gaatatatat tagagaatta
[579]agaaagacat gggaataaaa atattttaaa tccagtaaaa atatgataag attatttcag
[581]aatatgaaga actctgtttg tttttgatga aaaaacaaac aaaaaaaatc cacctaacgg
[583]aatctcaatt taactaacag cggccaaact gagaagttaa atttgagaag gggaaaaggc
[585]ggatttatac ttgtatttaa ctatctccat tttaacattt tattaaaccc catacaagtg
[587]aaaatcctct tttacactgt tcctttaggt gatcgcggag ggacattatg agtgaagtaa
[589]acctaaaagg aaatacagat gaattagtgt attatcgaca gcaaaccact ggaaataaaa
[591]tcgccaggaa gagaatcaaa aaagggaaag aagaagttta ttatgttgct gaaacggaag
[593]agaagatatg gacagaagag caaataaaaa acttttcttt agacaaattt ggtacgcata
[595]taccttacat agaaggtcat tatacaatct taaataatta cttctttgat ttttggggct
[597]attttttagg tgctgaagga attgcgctct atgctcacct aactcgttat gcatacggca
[599]gcaaagactt ttgctttcct agtctacaaa caatcgctaa aaaaatggac aagactcctg
[601]ttacagttag aggctacttg aaactgcttg aaaggtacgg ttttatttgg aaggtaaacg
[603]tccgtaataa aaccaaggat aacacagagg aatccccgat ttttaagatt agacgtaagg
[605]ttcctttgct ttcagaagaa cttttaaatg gaaaccctaa tattgaaatt ccagatgacg
[607]aggaagcaca tgtaaagaag gctttaaaaa aggaaaaaga gggtcttcca aaggttttga
[609]aaaaagagca cgatgaattt gttaaaaaaa tgatggatga gtcagaaaca attaatattc
[611]cagaggcctt acaatatgac acaatgtatg aagatatact cagtaaagga gaaattcgaa
[613]aagaaatcaa aaaacaaata cctaatccta caacatcttt tgagagtata tcaatgacaa
[615]ctgaagagga aaaagtcgac agtactttaa aaagcgaaat gcaaaatcgt gtctctaagc
[617]cttcttttga tacctggttt aaaaacacta agatcaaaat tgaaaataaa aattgtttat
[619]tacttgtacc gagtgaattt gcatttgaat ggattaagaa aagatattta gaaacaatta
[621]aaacagtcct tgaagaagct ggatatgttt tcgaaaaaat cgaactaaga aaagtgcaat
[623]aaactgctga agtatttcag cagttttttt tatttagaaa tagtgaaaaa aatataatca
[625]gggaggtatc aatatttaat gagtactgat ttaaatttat ttagactgga attaataatt
[627]aacacgtaga ctaattaaaa tttaatgagg gataaagagg atacaaaaat attaatttca
[629]atccctatta aattttaaca agggggggat taaaatttaa ttagaggttt atccacaaga
[631]aaagacccta ataaaatttt tactagggtt ataacactga ttaatttctt aatgggggag
[633]ggattaaaat ttaatgacaa agaaaacaat cttttaagaa aagcttttaa aagataataa
[635]taaaaagagc tttgcgatta agcaaaactc tttacttttt cattgacatt atcaaattca
[637]tcgatttcaa attgttgttg tatcataaag ttaattctgt tttgcacaac cttttcagga
[639]atataaaaca catctgaggc ttgttttata aactcagggt cgctaaagtc aatgtaacgt
[641]agcatatgat atggtatagc ttccacccaa gttagccttt ctgcttcttc tgaatgtttt
[643]tcatatactt ccatgggtat ctctaaatga ttttcctcat gtagcaaggt atgagcaaaa
[645]agtttatgga attgatagtt cctctctttt tcttcaactt ttttatctaa aacaaacact
[647]ttaacatctg agtcaatgta agcataagat gtttttccag tcataatttc aatcccaaat
[649]cttttagaca gaaattctgg acgtaaatct tttggtgaaa gaattttttt atgtagcaat
[651]atatccgata cagcaccttc taaaagcgtt ggtgaatagg gcattttacc tatctcctct
[653]cattttgtgg aataaaaata gtcatattcg tccatctacc tatcctatta tcgaacagtt
[655]gaacttttta atcaaggatc agtccttttt ttcattattc ttaaactgtg ctcttaactt
[657]taacaactcg atttgttttt ccagatctcg agggtaacta gcctcgccga tcccgcaaga
[659]ggcccggcag tcaggtggca cttttcgggg aaatgtgcgc ggaaccccta tttgtttatt
[661]tttctaaata cattcaaata tgtatccgct catgagacaa taaccctgat aaatgcttca
[663]ataatattga aaaaggaaga gtatgagtat tcaacatttc cgtgtcgccc ttattccctt
[665]ttttgcggca ttttgccttc ctgtttttgc tcacccagaa acgctggtga aagtaaaaga
[667]tgctgaagat cagttgggtg cacgagtggg ttacatcgaa ctggatctca acagcggtaa
[669]gatccttgag agttttcgcc ccgaagaacg ttttccaatg atgagcactt ttaaagttct
[671]gctatgtggc gcggtattat cccgtattga cgccgggcaa gagcaactcg gtcgccgcat
[673]acactattct cagaatgact tggttgagta ctcaccagtc acagaaaagc atcttacgga
[675]tggcatgaca gtaagagaat tatgcagtgc tgccataacc atgagtgata acactgcggc
[677]caacttactt ctgacaacga tcggaggacc gaaggagcta accgcttttt tgcacaacat
[679]gggggatcat gtaactcgcc ttgatcgttg ggaaccggag ctgaatgaag ccataccaaa
[681]cgacgagcgt gacaccacga tgcctgtagc aatggcaaca acgttgcgca aactattaac
[683]tggcgaacta cttactctag cttcccggca acaattaata gactggatgg aggcggataa
[685]agttgcagga ccacttctgc gctcggccct tccggctggc tggtttattg ctgataaatc
[687]tggagccggt gagcgtgggt ctcgcggtat cattgcagca ctggggccag atggtaagcc
[689]ctcccgtatc gtagttatct acacgacggg gagtcaggca actatggatg aacgaaatag
[691]acagatcgct gagataggtg cctcactgat taagcattgg taactgtcag accaagttta
[693]ctcatatata ctttagattg atttaaaact tcatttttaa tttaaaagga tctaggtgaa
[695]gatccttttt gataatctca tgaccaaaat cccttaacgt gagttttcgt tccactgagc
[697]gtcagacccc gtagaaaaga tcaaaggatc ttcttgagat cctttttttc tgcgcgtaat
[699]ctgctgcttg caaacaaaaa aaccaccgct accagcggtg gtttgtttgc cggatcaaga
[701]gctaccaact ctttttccga aggtaactgg cttcagcaga gcgcagatac caaatactgt
[703]ccttctagtg tagccgtagt taggccacca cttcaagaac tctgtagcac cgcctacata
[705]cctcgctctg ctaatcctgt taccagtggc tgctgccagt ggcgataagt cgtgtcttac
[707]cgggttggac tcaagacgat agttaccgga taaggcgcag cggtcgggct gaacgggggg
[709]ttcgtgcaca cagcccagct tggagcgaac gacctacacc gaactgagat acctacagcg
[711]tgagctatga gaaagcgcca cgcttcccga agggagaaag gcggacaggt atccggtaag
[713]cggcagggtc ggaacaggag agcgcacgag ggagcttcca gggggaaacg cctggtatct
[715]ttatagtcct gtcgggtttc gccacctctg acttgagcgt cgatttttgt gatgctcgtc
[717]aggggggcgg agcctatgga aaaacgccag caacgcggcc tttttacggt tcctggcctt
[719]ttgctggcct tttgctcaca tgttctttcc tgcgttatcc cctgattctg tggataaccg
[721]tattaccgcc tttgagtgag ctgataccgc tcgccgcagc cgaacgaccg agcgcagcga
[723]gtcagtgagc gaggaagcgg aagagcgccc aatacgcatg c
[728]<213> Искусственная последовательность
[732]ttaagttatt ggtatgactg gttttaagcg caaaaaaagt tgctttttcg tacctattaa
[734]tgtatcgttt tagaaaaccg actgtaaaaa gtacagtcgg cattatctca tattataaaa
[736]gccagtcatt aggcctatct gacaattcct gaatagagtt cataaacaat cctgcatgat
[738]aaccatcaca aacagaatga tgtacctgta aagatagcgg taaatatatt gaattacctt
[740]tattaatgaa ttttcctgct gtaataatgg gtagaaggta attactatta ttattgatat
[742]ttaagttaaa cccagtaaat gaagtccatg gaataataga aagagaaaaa gcattttcag
[744]gtataggtgt tttgggaaac aatttccccg aaccattata tttctctaca tcagaaaggt
[746]ataaatcata aaactctttg aagtcattct ttacaggagt ccaaatacca gagaatgttt
[748]tagatacacc atcaaaaatt gtataaagtg gctctaactt atcccaataa cctaactctc
[750]cgtcgctatt gtaaccagtt ctaaaagctg tatttgagtt tatcaccctt gtcactaaga
[752]aaataaatgc agggtaaaat ttatatcctt cttgttttat gtttcggtat aaaacactaa
[754]tatcaatttc tgtggttata ctaaaagtcg tttgttggtt caaataatga ttaaatatct
[756]cttttctctt ccaattgtct aaatcaattt tattaaagtt catttgatat gcctcctaaa
[758]tttttatcta aagtgaattt aggaggctta cttgtctgct ttcttcatta gaatcaatcc
[760]ttttttaaaa gtcaatatta ctgtaacata aatatatatt ttaaaaatat cccactttat
[762]ccaattttcg tttgttgaac taatgggtgc tttagttgaa gaataaagac cacattaaaa
[764]aatgtggtct tttgtgtttt tttaaaggat ttgagcgtag cgaaaaatcc ttttctttct
[766]tatcttgata ataagggtaa ctattgccga tcgtccattc cgacagcatc gccagtcact
[768]atggcgtgct gctagcattt tacattttta gaaatgggcg tgaaaaaaag cgcgcgatta
[770]tgtaaaatat aaagattaac taataaggag gacaaacatg aaagaaatca aaatccaaaa
[772]catcatcatc agcgaagaaa aagcgccgct ggttgtgccg gaaatcggca ttaatcataa
[774]cggatcttta gaactggcta aaatcatggt tgatgcagcg ttttcagctg gagccaaaat
[776]catcaaacat caaacacata tcgtcgaaga tgaaatgagc aaagctgcaa agaaagttat
[778]cccgggcaac gctaaaatct ctatctacga aatcatgcag aaatgcgctt tagattacaa
[780]agatgaactt gccctgaaag aatacacaga aaaactggga cttgtgtatc ttagcacacc
[782]gttttcaaga gcaggcgcga atcgcttaga agatatggga gtctctgcat ttaaaatcgg
[784]ctcaggagaa tgtaataact atccgctgat caaacatatt gcagcgttta aaaaaccgat
[786]gattgtgtct acaggcatga actcaatcga aagcattaaa ccgacagtga aaatcctgct
[788]tgataacgaa atcccgtttg tcctgatgca tacaacaaac ctgtatccga caccgcataa
[790]tcttgttaga ttaaacgcca tgctggaact gaagaaagaa tttagctgca tggtgggact
[792]ttctgatcat acaacagata atctggcatg ccttggcgcg gtcgttcttg gagcgtgtgt
[794]cttagaaaga cattttacag attcaatgca tcgcagcgga ccggatattg tttgttctat
[796]ggatacaaaa gccttaaaag aactgatcat tcaatcagaa cagatggcaa tcattcgcgg
[798]caataacgaa tcaaagaaag cagccaaaca agaacaggtt acaatcgatt ttgcttttgc
[800]ctctgtggtc tcaatcaaag atattaagaa aggcgaagtt ctgtcaatgg ataatatttg
[802]ggtgaaaaga ccgggacttg gcggaatcag cgcagcggaa tttgaaaata ttctgggcaa
[804]gaaagcactg cgcgatattg aaaacgatgc gcagttaagc tatgaagatt ttgcttaagc
[806]tcttaaggag gattttagaa tgaagaaaat tctgtttatc acaggctcaa gagcggatta
[808]ctctaaaatc aaatcactta tgtaccgcgt ccaaaattca agcgaatttg aactttacat
[810]ctttgctaca ggcatgcatc tgagcaaaaa ctttggatac acagttaaag aattatataa
[812]aaatggcttt aaaaacatct acgaatttat caactacgat aaatattatc agacagataa
[814]agccctggca acaacaattg atggattttc aagatatgcg aacgaattaa aaccggatct
[816]gattgttgtg catggcgatc gcatcgaacc gcttgcagcg gctattgtcg gagcccttaa
[818]caacatcctg gttgcacata tcgaaggcgg agaaattagc ggaacaatcg atgattcttt
[820]aagacatgcg atttcaaaac ttgctcatat ccatctggtg aacgatgaat ttgcaaaaag
[822]acgccttatg caattaggcg aagatgaaaa atcaatcttt atcatcggat ctccggatct
[824]ggaactgctt aacgataaca aaatctcact tagcgaagcc aaaaaatact acgatattaa
[826]ctacgaaaac tatgcattac tgatgtttca tccggtcaca acagaaatca catctatcaa
[828]aaaccaagcc gataacctgg tgaaagcact tatccagtca aacaaaaact acatcgtcat
[830]ctatccgaat aacgatctgg gctttgaact gatccttcag agctatgaag aatttaaaaa
[832]caacccgaga tttaaactgt ttccgtctct gcgctttgaa tactttatca cacttctgaa
[834]aaacgccgat tttattatcg gaaactcttc atgcatcctg aaagaagcgt tatacctgaa
[836]aacagctggc attctggttg gatcaagaca aaatggccgc ttaggaaatg aaaacacact
[838]gaaagtgaat gcgaacagcg atgaaatcct taaagctatc aacacaatcc ataaaaaaca
[840]ggatttattt tctgctaaac tggaaattct tgatagctct aaactgtttt tcgaatatct
[842]tcaatcaggc gatttcttta aacttagcac acagaaagtt tttaaagata ttaaataaaa
[844]aggaggaact actatgtcac ttgcaattat cccggcgaga ggcggaagca aaggcatcaa
[846]aaacaaaaac ctggttctgc ttaacaacaa accgcttatc tactacacaa tcaaagcagc
[848]gctgaatgct aaatctattt caaaagttgt ggtctcaagc gatagcgatg aaatccttaa
[850]ctacgccaaa tctcaaaacg tggatattct gaaaagaccg atctctcttg cacaggatga
[852]tacaacatca gataaagtct tactgcatgc gctgaaattt tacaaagatt acgaagatgt
[854]tgtgttttta caaccgacat ctccgctgcg cacaaacatt catatcaacg aagcatttaa
[856]cctgtacaaa aattcaaacg ctaatgccct gattagcgtc tctgaatgcg ataacaaaat
[858]ccttaaagca tttgtttgca acgattgtgg cgatttagcc ggaatttgta atgatgaata
[860]tccgtttatg ccgcgccaga aactgccgaa aacatatatg agcaacggag cgatctacat
[862]ccttaaaatc aaagaatttc tgaacaaccc gtcatttctg caaagcaaaa caaaacattt
[864]tcttatggat gaatcatcat cactggatat tgattgcctg gaagatttaa agaaagttga
[866]acaaatttgg aaaaaataaa gtcaatgtat gaatggatac gggatatgaa tcaataagta
[868]cgtgaaagag aaaagcaacc cagatatgat agggaacttt tctctttctt gttttacatt
[870]gaatctttac aatcctattg atataatcta agctagtgta ttttgcgttt aatagtggag
[872]aaaagctagc gattaactaa taaggaggac aaacatggat aaatttgctg aacatgaaat
[874]tccgaaagct gttatcgtgg ccggcaacgg agaatctctt tcacaaatcg attacagact
[876]gcttccgaaa aactatgatg tctttagatg caaccagttt tactttgaag aacgctattt
[878]tcttggcaac aaaatcaaag cagttttctt tacaccggga gtgtttttag aacaatacta
[880]cacactgtac catcttaaac gcaacaacga atactttgtc gataacgtta tcctgtcatc
[882]atttaaccat ccgacagttg atctggaaaa atcacaaaaa atccaggctc tgtttattga
[884]tgtgatcaac ggctacgaaa aatacctgtc taaactgaca gcctttgatg tttatctgag
[886]atacaaagaa ctttacgaaa accaacgcat tacatcagga gtgtatatgt gcgccgtcgc
[888]aatcgcgatg ggctatacag atatttacct tacaggaatc gatttttatc aggcaagcga
[890]agaaaactac gcgtttgata acaaaaaacc gaacatcatc agattactgc cggattttcg
[892]caaagaaaaa acattatttt catatcatag caaagatatt gatcttgaag cattatcttt
[894]tctgcaacag cattaccatg ttaactttta cagcatttct ccgatgtctc cgctgtcaaa
[896]acattttccg atcccgacag tggaagatga ttgtgaaaca acatttgtcg cgccgctgaa
[898]agaaaactac atcaacgata ttcttttacc gccgcatttt gtctatgaaa aacttggcgt
[900]tgataaactt gcagcggctt tagaacatca tcatcatcat cattaaagtg atagcggtac
[902]cattataggt aagagaggaa tgtacacatg tactatttaa aaaacacaaa cttttggatg
[904]ttcggtttat tctttttctt ttactttttt atcatgggag cctacttccc gtttttcccg
[906]atttggctac atgacatcaa ccatatcagc aaaagtgata cgggtattat ttttgccgct
[908]atttctctgt tctcgctatt attccaaccg ctgtttggtc tgctttctga caaactcggg
[910]ctgcgcaaat acctgctgtg gattattacc ggcatgttag tgatgtttgc gccgttcttt
[912]atttttatct tcgggccact gttacaatac aacattttag taggatcgat tgttggtggt
[914]atttatctag gcttttgttt taacgccggt gcgccagcag tagaggcatt tattgagaaa
[916]gtcagccgtc gcagtaattt cgaatttggt cgcgcgcgga tgtttggctg tgttggctgg
[918]gcgctgtgtg cctcgattgt cggcatcatg ttcaccatca ataatcagtt tgttttctgg
[920]ctgggctctg gctgtgcact catcctcgcc gttttactct ttttcgccaa aacggatgcg
[922]ccctcttctg ccacggttgc caatgcggta ggtgccaacc attcggcatt tagccttaag
[924]ctggcactgg aactgttcag acagccaaaa ctgtggtttt tgtcactgta tgttattggc
[926]gtttcctgca cctacgatgt ttttgaccaa cagtttgcta atttctttac ttcgttcttt
[928]gctaccggtg aacagggtac gcgggtattt ggctacgtaa cgacaatggg cgaattactt
[930]aacgcctcga ttatgttctt tgcgccactg atcattaatc gcatcggtgg gaaaaacgcc
[932]ctgctgctgg ctggcactat tatgtctgta cgtattattg gctcatcgtt cgccacctca
[934]gcgctggaag tggttattct gaaaacgctg catatgtttg aagtaccgtt cctgctggtg
[936]ggctgcttta aatatattac cagccagttt gaagtgcgtt tttcagcgac gatttatctg
[938]gtctgtttct gcttctttaa gcaactggcg atgattttta tgtctgtact ggcgggcaat
[940]atgtatgaaa gcatcggttt ccagggcgct tatctggtgc tgggtctggt ggcgctgggc
[942]ttcaccttaa tttccgtgtt cacgcttagc ggccccggcc cgctttccct gctgcgtcgt
[944]caggtgaatg aagtcgctta aggatccatg tctagagtcg acgtccccgg ggcagcccgc
[946]ctaatgagcg ggcttttttc acgtcccagg catcaaataa aacgaaaggc tcagtcgaaa
[948]gactgggcct ttcgttttat ctgttgtttg tcggtgaacg ctctctacta gagtcacact
[950]ggctcacctt cgggtgggcc tttctgcgtt tatagaattc atattactta gaggatacta
[952]ttgagagagc tattgataag atggttgaga cattacctga gagccaaaaa actttttatg
[954]aatatgaatt aaaaaaaaga accaacaaag gctgagacag actccaaacg agtctgtttt
[956]tttaaaaaaa atattaggag cattgaatat atattagaga attaagaaag acatgggaat
[958]aaaaatattt taaatccagt aaaaatatga taagattatt tcagaatatg aagaactctg
[960]tttgtttttg atgaaaaaac aaacaaaaaa aatccaccta acggaatctc aatttaacta
[962]acagcggcca aactgagaag ttaaatttga gaaggggaaa aggcggattt atacttgtat
[964]ttaactatct ccattttaac attttattaa accccataca agtgaaaatc ctcttttaca
[966]ctgttccttt aggtgatcgc ggagggacat tatgagtgaa gtaaacctaa aaggaaatac
[968]agatgaatta gtgtattatc gacagcaaac cactggaaat aaaatcgcca ggaagagaat
[970]caaaaaaggg aaagaagaag tttattatgt tgctgaaacg gaagagaaga tatggacaga
[972]agagcaaata aaaaactttt ctttagacaa atttggtacg catatacctt acatagaagg
[974]tcattataca atcttaaata attacttctt tgatttttgg ggctattttt taggtgctga
[976]aggaattgcg ctctatgctc acctaactcg ttatgcatac ggcagcaaag acttttgctt
[978]tcctagtcta caaacaatcg ctaaaaaaat ggacaagact cctgttacag ttagaggcta
[980]cttgaaactg cttgaaaggt acggttttat ttggaaggta aacgtccgta ataaaaccaa
[982]ggataacaca gaggaatccc cgatttttaa gattagacgt aaggttcctt tgctttcaga
[984]agaactttta aatggaaacc ctaatattga aattccagat gacgaggaag cacatgtaaa
[986]gaaggcttta aaaaaggaaa aagagggtct tccaaaggtt ttgaaaaaag agcacgatga
[988]atttgttaaa aaaatgatgg atgagtcaga aacaattaat attccagagg ccttacaata
[990]tgacacaatg tatgaagata tactcagtaa aggagaaatt cgaaaagaaa tcaaaaaaca
[992]aatacctaat cctacaacat cttttgagag tatatcaatg acaactgaag aggaaaaagt
[994]cgacagtact ttaaaaagcg aaatgcaaaa tcgtgtctct aagccttctt ttgatacctg
[996]gtttaaaaac actaagatca aaattgaaaa taaaaattgt ttattacttg taccgagtga
[998]atttgcattt gaatggatta agaaaagata tttagaaaca attaaaacag tccttgaaga
[1000]agctggatat gttttcgaaa aaatcgaact aagaaaagtg caataaactg ctgaagtatt
[1002]tcagcagttt tttttattta gaaatagtga aaaaaatata atcagggagg tatcaatatt
[1004]taatgagtac tgatttaaat ttatttagac tggaattaat aattaacacg tagactaatt
[1006]aaaatttaat gagggataaa gaggatacaa aaatattaat ttcaatccct attaaatttt
[1008]aacaaggggg ggattaaaat ttaattagag gtttatccac aagaaaagac cctaataaaa
[1010]tttttactag ggttataaca ctgattaatt tcttaatggg ggagggatta aaatttaatg
[1012]acaaagaaaa caatctttta agaaaagctt ttaaaagata ataataaaaa gagctttgcg
[1014]attaagcaaa actctttact ttttcattga cattatcaaa ttcatcgatt tcaaattgtt
[1016]gttgtatcat aaagttaatt ctgttttgca caaccttttc aggaatataa aacacatctg
[1018]aggcttgttt tataaactca gggtcgctaa agtcaatgta acgtagcata tgatatggta
[1020]tagcttccac ccaagttagc ctttctgctt cttctgaatg tttttcatat acttccatgg
[1022]gtatctctaa atgattttcc tcatgtagca aggtatgagc aaaaagttta tggaattgat
[1024]agttcctctc tttttcttca acttttttat ctaaaacaaa cactttaaca tctgagtcaa
[1026]tgtaagcata agatgttttt ccagtcataa tttcaatccc aaatctttta gacagaaatt
[1028]ctggacgtaa atcttttggt gaaagaattt ttttatgtag caatatatcc gatacagcac
[1030]cttctaaaag cgttggtgaa tagggcattt tacctatctc ctctcatttt gtggaataaa
[1032]aatagtcata ttcgtccatc tacctatcct attatcgaac agttgaactt tttaatcaag
[1034]gatcagtcct ttttttcatt attcttaaac tgtgctctta actttaacaa ctcgatttgt
[1036]ttttccagat ctcgagggta actagcctcg ccgatcccgc aagaggcccg gcagtcaggt
[1038]ggcacttttc ggggaaatgt gcgcggaacc cctatttgtt tatttttcta aatacattca
[1040]aatatgtatc cgctcatgag acaataaccc tgataaatgc ttcaataata ttgaaaaagg
[1042]aagagtatga gtattcaaca tttccgtgtc gcccttattc ccttttttgc ggcattttgc
[1044]cttcctgttt ttgctcaccc agaaacgctg gtgaaagtaa aagatgctga agatcagttg
[1046]ggtgcacgag tgggttacat cgaactggat ctcaacagcg gtaagatcct tgagagtttt
[1048]cgccccgaag aacgttttcc aatgatgagc acttttaaag ttctgctatg tggcgcggta
[1050]ttatcccgta ttgacgccgg gcaagagcaa ctcggtcgcc gcatacacta ttctcagaat
[1052]gacttggttg agtactcacc agtcacagaa aagcatctta cggatggcat gacagtaaga
[1054]gaattatgca gtgctgccat aaccatgagt gataacactg cggccaactt acttctgaca
[1056]acgatcggag gaccgaagga gctaaccgct tttttgcaca acatggggga tcatgtaact
[1058]cgccttgatc gttgggaacc ggagctgaat gaagccatac caaacgacga gcgtgacacc
[1060]acgatgcctg tagcaatggc aacaacgttg cgcaaactat taactggcga actacttact
[1062]ctagcttccc ggcaacaatt aatagactgg atggaggcgg ataaagttgc aggaccactt
[1064]ctgcgctcgg cccttccggc tggctggttt attgctgata aatctggagc cggtgagcgt
[1066]gggtctcgcg gtatcattgc agcactgggg ccagatggta agccctcccg tatcgtagtt
[1068]atctacacga cggggagtca ggcaactatg gatgaacgaa atagacagat cgctgagata
[1070]ggtgcctcac tgattaagca ttggtaactg tcagaccaag tttactcata tatactttag
[1072]attgatttaa aacttcattt ttaatttaaa aggatctagg tgaagatcct ttttgataat
[1074]ctcatgacca aaatccctta acgtgagttt tcgttccact gagcgtcaga ccccgtagaa
[1076]aagatcaaag gatcttcttg agatcctttt tttctgcgcg taatctgctg cttgcaaaca
[1078]aaaaaaccac cgctaccagc ggtggtttgt ttgccggatc aagagctacc aactcttttt
[1080]ccgaaggtaa ctggcttcag cagagcgcag ataccaaata ctgtccttct agtgtagccg
[1082]tagttaggcc accacttcaa gaactctgta gcaccgccta catacctcgc tctgctaatc
[1084]ctgttaccag tggctgctgc cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga
[1086]cgatagttac cggataaggc gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc
[1088]agcttggagc gaacgaccta caccgaactg agatacctac agcgtgagct atgagaaagc
[1090]gccacgcttc ccgaagggag aaaggcggac aggtatccgg taagcggcag ggtcggaaca
[1092]ggagagcgca cgagggagct tccaggggga aacgcctggt atctttatag tcctgtcggg
[1094]tttcgccacc tctgacttga gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta
[1096]tggaaaaacg ccagcaacgc ggccttttta cggttcctgg ccttttgctg gccttttgct
[1098]cacatgttct ttcctgcgtt atcccctgat tctgtggata accgtattac cgcctttgag
[1100]tgagctgata ccgctcgccg cagccgaacg accgagcgca gcgagtcagt gagcgaggaa
[1102]gcggaagagc gcccaatacg catgc
[1107]<213> Искусственная последовательность
[1109]<223> Экспрессионная плазмида
[1111]ttaagttatt ggtatgactg gttttaagcg caaaaaaagt tgctttttcg tacctattaa
[1113]tgtatcgttt tagaaaaccg actgtaaaaa gtacagtcgg cattatctca tattataaaa
[1115]gccagtcatt aggcctatct gacaattcct gaatagagtt cataaacaat cctgcatgat
[1117]aaccatcaca aacagaatga tgtacctgta aagatagcgg taaatatatt gaattacctt
[1119]tattaatgaa ttttcctgct gtaataatgg gtagaaggta attactatta ttattgatat
[1121]ttaagttaaa cccagtaaat gaagtccatg gaataataga aagagaaaaa gcattttcag
[1123]gtataggtgt tttgggaaac aatttccccg aaccattata tttctctaca tcagaaaggt
[1125]ataaatcata aaactctttg aagtcattct ttacaggagt ccaaatacca gagaatgttt
[1127]tagatacacc atcaaaaatt gtataaagtg gctctaactt atcccaataa cctaactctc
[1129]cgtcgctatt gtaaccagtt ctaaaagctg tatttgagtt tatcaccctt gtcactaaga
[1131]aaataaatgc agggtaaaat ttatatcctt cttgttttat gtttcggtat aaaacactaa
[1133]tatcaatttc tgtggttata ctaaaagtcg tttgttggtt caaataatga ttaaatatct
[1135]cttttctctt ccaattgtct aaatcaattt tattaaagtt catttgatat gcctcctaaa
[1137]tttttatcta aagtgaattt aggaggctta cttgtctgct ttcttcatta gaatcaatcc
[1139]ttttttaaaa gtcaatatta ctgtaacata aatatatatt ttaaaaatat cccactttat
[1141]ccaattttcg tttgttgaac taatgggtgc tttagttgaa gaataaagac cacattaaaa
[1143]aatgtggtct tttgtgtttt tttaaaggat ttgagcgtag cgaaaaatcc ttttctttct
[1145]tatcttgata ataagggtaa ctattgccga tcgtccattc cgacagcatc gccagtcact
[1147]atggcgtgct gctagcgcca ttcgccattc aggctgcgca actgttggga agggcgatcg
[1149]gtgcgggcct cttcgctatt acgccagctg gcgaaagggg gatgtgctgc aaggcgatta
[1151]agttgggtaa cgccagggtt ttcccagtca cgacgttgta aaacgacggc cagtgaattc
[1153]gagctcaggc cttaactcac attaattgcg ttgcgctcac tgcccgcttt ccagtcggga
[1155]aacctgtcgt gccagctgca ttaatgaatc ggccaacgcg cggggagagg cggtttgcgt
[1157]attgggcgcc agggtggttt ttcttttcac cagtgagacg ggcaacagct gattgccctt
[1159]caccgcctgg ccctgagaga gttgcagcaa gcggtccacg ctggtttgcc ccagcaggcg
[1161]aaaatcctgt ttgatggtgg ttgacggcgg gatataacat gagctgtctt cggtatcgtc
[1163]gtatcccact accgagatat ccgcaccaac gcgcagcccg gactcggtaa tggcgcgcat
[1165]tgcgcccagc gccatctgat cgttggcaac cagcatcgca gtgggaacga tgccctcatt
[1167]cagcatttgc atggtttgtt gaaaaccgga catggcactc cagtcgcctt cccgttccgc
[1169]tatcggctga atttgattgc gagtgagata tttatgccag ccagccagac gcagacgcgc
[1171]cgagacagaa cttaatgggc ccgctaacag cgcgatttgc tggtgaccca atgcgaccag
[1173]atgctccacg cccagtcgcg taccgtcttc atgggagaaa ataatactgt tgatgggtgt
[1175]ctggtcagag acatcaagaa ataacgccgg aacattagtg caggcagctt ccacagcaat
[1177]ggcatcctgg tcatccagcg gatagttaat gatcagccca ctgacgcgtt gcgcgagaag
[1179]attgtgcacc gccgctttac aggcttcgac gccgcttcgt tctaccatcg acaccaccac
[1181]gctggcaccc agttgatcgg cgcgagattt aatcgccgcg acaatttgcg acggcgcgtg
[1183]cagggccaga ctggaggtgg caacgccaat cagcaacgac tgtttgcccg ccagttgttg
[1185]tgccacgcgg ttgggaatgt aattcagctc cgccatcgcc gcttccactt tttcccgcgt
[1187]tttcgcagaa acgtggctgg cctggttcac cacgcgggaa acggtctgat aagagacacc
[1189]ggcatactct gcgacatcgt ataacgttac tggtttcatc aaaatcgtct ccctccgttt
[1191]gaatatttga ttgatcgtaa ccagatgaag cactctttcc actatcccta cagtgttatg
[1193]gcttgaacaa tcacgaaaca ataattggta cgtacgatct ttcagccgac tcaaacatca
[1195]aatcttacaa atgtagtctt tgaaagtatt acatatgtaa gatttaaatg caaccgtttt
[1197]ttcggaagga aatgatgacc tcgtttccac cggaattagc ttggtaccaa aggaggtaag
[1199]gatcactaga aaatttttta aaaaatctct tgacattgga agggagatat gttattataa
[1201]gaattgcgga attgtgagcg gataacaatt cccatataga ttaactaata aggaggacaa
[1203]acatgaaaga aatcaaaatc caaaacatca tcatcagcga agaaaaagcg ccgctggttg
[1205]tgccggaaat cggcattaat cataacggat ctttagaact ggctaaaatc atggttgatg
[1207]cagcgttttc agctggagcc aaaatcatca aacatcaaac acatatcgtc gaagatgaaa
[1209]tgagcaaagc tgcaaagaaa gttatcccgg gcaacgctaa aatctctatc tacgaaatca
[1211]tgcagaaatg cgctttagat tacaaagatg aacttgccct gaaagaatac acagaaaaac
[1213]tgggacttgt gtatcttagc acaccgtttt caagagcagg cgcgaatcgc ttagaagata
[1215]tgggagtctc tgcatttaaa atcggctcag gagaatgtaa taactatccg ctgatcaaac
[1217]atattgcagc gtttaaaaaa ccgatgattg tgtctacagg catgaactca atcgaaagca
[1219]ttaaaccgac agtgaaaatc ctgcttgata acgaaatccc gtttgtcctg atgcatacaa
[1221]caaacctgta tccgacaccg cataatcttg ttagattaaa cgccatgctg gaactgaaga
[1223]aagaatttag ctgcatggtg ggactttctg atcatacaac agataatctg gcatgccttg
[1225]gcgcggtcgt tcttggagcg tgtgtcttag aaagacattt tacagattca atgcatcgca
[1227]gcggaccgga tattgtttgt tctatggata caaaagcctt aaaagaactg atcattcaat
[1229]cagaacagat ggcaatcatt cgcggcaata acgaatcaaa gaaagcagcc aaacaagaac
[1231]aggttacaat cgattttgct tttgcctctg tggtctcaat caaagatatt aagaaaggcg
[1233]aagttctgtc aatggataat atttgggtga aaagaccggg acttggcgga atcagcgcag
[1235]cggaatttga aaatattctg ggcaagaaag cactgcgcga tattgaaaac gatgcgcagt
[1237]taagctatga agattttgct taagctctta aggaggattt tagaatgaag aaaattctgt
[1239]ttatcacagg ctcaagagcg gattactcta aaatcaaatc acttatgtac cgcgtccaaa
[1241]attcaagcga atttgaactt tacatctttg ctacaggcat gcatctgagc aaaaactttg
[1243]gatacacagt taaagaatta tataaaaatg gctttaaaaa catctacgaa tttatcaact
[1245]acgataaata ttatcagaca gataaagccc tggcaacaac aattgatgga ttttcaagat
[1247]atgcgaacga attaaaaccg gatctgattg ttgtgcatgg cgatcgcatc gaaccgcttg
[1249]cagcggctat tgtcggagcc cttaacaaca tcctggttgc acatatcgaa ggcggagaaa
[1251]ttagcggaac aatcgatgat tctttaagac atgcgatttc aaaacttgct catatccatc
[1253]tggtgaacga tgaatttgca aaaagacgcc ttatgcaatt aggcgaagat gaaaaatcaa
[1255]tctttatcat cggatctccg gatctggaac tgcttaacga taacaaaatc tcacttagcg
[1257]aagccaaaaa atactacgat attaactacg aaaactatgc attactgatg tttcatccgg
[1259]tcacaacaga aatcacatct atcaaaaacc aagccgataa cctggtgaaa gcacttatcc
[1261]agtcaaacaa aaactacatc gtcatctatc cgaataacga tctgggcttt gaactgatcc
[1263]ttcagagcta tgaagaattt aaaaacaacc cgagatttaa actgtttccg tctctgcgct
[1265]ttgaatactt tatcacactt ctgaaaaacg ccgattttat tatcggaaac tcttcatgca
[1267]tcctgaaaga agcgttatac ctgaaaacag ctggcattct ggttggatca agacaaaatg
[1269]gccgcttagg aaatgaaaac acactgaaag tgaatgcgaa cagcgatgaa atccttaaag
[1271]ctatcaacac aatccataaa aaacaggatt tattttctgc taaactggaa attcttgata
[1273]gctctaaact gtttttcgaa tatcttcaat caggcgattt ctttaaactt agcacacaga
[1275]aagtttttaa agatattaaa taaaaaggag gaactactat gtcacttgca attatcccgg
[1277]cgagaggcgg aagcaaaggc atcaaaaaca aaaacctggt tctgcttaac aacaaaccgc
[1279]ttatctacta cacaatcaaa gcagcgctga atgctaaatc tatttcaaaa gttgtggtct
[1281]caagcgatag cgatgaaatc cttaactacg ccaaatctca aaacgtggat attctgaaaa
[1283]gaccgatctc tcttgcacag gatgatacaa catcagataa agtcttactg catgcgctga
[1285]aattttacaa agattacgaa gatgttgtgt ttttacaacc gacatctccg ctgcgcacaa
[1287]acattcatat caacgaagca tttaacctgt acaaaaattc aaacgctaat gccctgatta
[1289]gcgtctctga atgcgataac aaaatcctta aagcatttgt ttgcaacgat tgtggcgatt
[1291]tagccggaat ttgtaatgat gaatatccgt ttatgccgcg ccagaaactg ccgaaaacat
[1293]atatgagcaa cggagcgatc tacatcctta aaatcaaaga atttctgaac aacccgtcat
[1295]ttctgcaaag caaaacaaaa cattttctta tggatgaatc atcatcactg gatattgatt
[1297]gcctggaaga tttaaagaaa gttgaacaaa tttggaaaaa ataaagatta actaataagg
[1299]aggacaaaca tgaaaagaat cttttgcctt gtgtctgcaa tcctgctttc agcgtgtaat
[1301]gataaccaga atacagtcga tgttgtggtc tcaacagtga acgataacgt catcgaaaac
[1303]aacacatacc aggtcaaacc gatcgataca ccgacaacat ttgatagcta ttcttggatt
[1305]caaacatgcg gcacaccgat ccttaaagat gatgaaaaat actcactgtc atttgatttt
[1307]gttgctccgg aattagatca ggatgaaaaa ttttgttttg aatttacagg cgatgttgat
[1309]ggaaaacgct atgtgacaca aacaaatctg acagttgtgg caccgacact tgaagtgtat
[1311]gtcgatcatg cgagcctgcc gtctcttcaa cagctgatga aaatcatcca acagaaaaac
[1313]gaatactctc agaacgaaag atttatctca tggggccgca tcggacttac agaagataac
[1315]gctgaaaaac tgaatgccca tatttatccg ctggctggaa ataacacatc tcaagaatta
[1317]gtcgatgcag ttatcgatta cgcggattca aaaaacagac tgaatctgga acttaacaca
[1319]aacacagctc atagctttcc gaacttagcc ccgattctgc gcattatctc aagcaaaagc
[1321]aacatcctga tctctaacat caacctttac gatgatggct cagccgaata cgtgaacctg
[1323]tacaactgga aagatacaga agataaaagc gtcaaactgt ctgattcatt tttagttctg
[1325]aaagattact ttaatggaat ttcttcagaa aaaccgagcg gcatctatgg aagatataac
[1327]tggcatcagc tgtacaacac atcttactat tttctgagaa aagattatct gacagtcgaa
[1329]ccgcaactgc atgatcttcg cgaatatctt ggcggatcat taaaacagat gagctgggat
[1331]ggcttttcac aactgagcaa aggagataaa gaactgtttc tgaacattgt tggctttgat
[1333]caagaaaaac tgcaacagga atatcaacag agcgaacttc cgaattttgt gtttacagga
[1335]acaacaacat gggcaggcgg agaaacaaaa gaatattatg cgcaacagca agttaacgtc
[1337]gttaacaacg caatcaacga aacatctccg tactacctgg gcagagaaca tgatcttttc
[1339]tttaaaggac atccgcgcgg cggaattatc aatgatatta tcctgggctc atttaataac
[1341]atgattgata ttccggcgaa agttagcttt gaagtgctta tgatgacagg aatgttaccg
[1343]gatacagtgg gcggaattgc atcatcactg tattttagca tcccggccga aaaagtctct
[1345]tttatcgttt ttacatcaag cgatacaatc acagatcgcg aagatgctct gaaatctccg
[1347]cttgttcagg tgatgatgac actgggcatt gtgaaagaaa aagatgtcct gttttggtca
[1349]gatttaccgg attgctcttc aggagtttgt attgcccaat attaaagtga tagcggtacc
[1351]attataggta agagaggaat gtacacatgt actatttaaa aaacacaaac ttttggatgt
[1353]tcggtttatt ctttttcttt tactttttta tcatgggagc ctacttcccg tttttcccga
[1355]tttggctaca tgacatcaac catatcagca aaagtgatac gggtattatt tttgccgcta
[1357]tttctctgtt ctcgctatta ttccaaccgc tgtttggtct gctttctgac aaactcgggc
[1359]tgcgcaaata cctgctgtgg attattaccg gcatgttagt gatgtttgcg ccgttcttta
[1361]tttttatctt cgggccactg ttacaataca acattttagt aggatcgatt gttggtggta
[1363]tttatctagg cttttgtttt aacgccggtg cgccagcagt agaggcattt attgagaaag
[1365]tcagccgtcg cagtaatttc gaatttggtc gcgcgcggat gtttggctgt gttggctggg
[1367]cgctgtgtgc ctcgattgtc ggcatcatgt tcaccatcaa taatcagttt gttttctggc
[1369]tgggctctgg ctgtgcactc atcctcgccg ttttactctt tttcgccaaa acggatgcgc
[1371]cctcttctgc cacggttgcc aatgcggtag gtgccaacca ttcggcattt agccttaagc
[1373]tggcactgga actgttcaga cagccaaaac tgtggttttt gtcactgtat gttattggcg
[1375]tttcctgcac ctacgatgtt tttgaccaac agtttgctaa tttctttact tcgttctttg
[1377]ctaccggtga acagggtacg cgggtatttg gctacgtaac gacaatgggc gaattactta
[1379]acgcctcgat tatgttcttt gcgccactga tcattaatcg catcggtggg aaaaacgccc
[1381]tgctgctggc tggcactatt atgtctgtac gtattattgg ctcatcgttc gccacctcag
[1383]cgctggaagt ggttattctg aaaacgctgc atatgtttga agtaccgttc ctgctggtgg
[1385]gctgctttaa atatattacc agccagtttg aagtgcgttt ttcagcgacg atttatctgg
[1387]tctgtttctg cttctttaag caactggcga tgatttttat gtctgtactg gcgggcaata
[1389]tgtatgaaag catcggtttc cagggcgctt atctggtgct gggtctggtg gcgctgggct
[1391]tcaccttaat ttccgtgttc acgcttagcg gccccggccc gctttccctg ctgcgtcgtc
[1393]aggtgaatga agtcgcttaa ggatccatgt ctagagtcga cgtccccggg gcagcccgcc
[1395]taatgagcgg gcttttttca cgtcccaggc atcaaataaa acgaaaggct cagtcgaaag
[1397]actgggcctt tcgttttatc tgttgtttgt cggtgaacgc tctctactag agtcacactg
[1399]gctcaccttc gggtgggcct ttctgcgttt atacccgggg cagcccgcct aatgagcggg
[1401]cttttttcac gtcacgcgtc catggagatc tttgtctgca actgaaaagt ttatacctta
[1403]cctggaacaa atggttgaaa catacgaggc taatatcggc ttattaggaa tagtccctgt
[1405]actaataaaa tcaggtggat cagttgatca gtatattttg gacgaagctc ggaaagaatt
[1407]tggagatgac ttgcttaatt ccacaattaa attaagggaa agaataaagc gatttgatgt
[1409]tcaaggaatc acggaagaag atactcatga taaagaagct ctaaaactat tcaataacct
[1411]tacaatggaa ttgatcgaaa gggtggaagg ttaatggtac gaaaattagg ggatctacct
[1413]agaaagccac aaggcgatag gtcaagctta aagaaccctt acatggatct tacagattct
[1415]gaaagtaaag aaacaacaga ggttaaacaa acagaaccaa aaagaaaaaa agcattgttg
[1417]aaaacaatga aagttgatgt ttcaatccat aataagatta aatcgctgca cgaaattctg
[1419]gcagcatccg aagggaattc atattactta gaggatacta ttgagagagc tattgataag
[1421]atggttgaga cattacctga gagccaaaaa actttttatg aatatgaatt aaaaaaaaga
[1423]accaacaaag gctgagacag actccaaacg agtctgtttt tttaaaaaaa atattaggag
[1425]cattgaatat atattagaga attaagaaag acatgggaat aaaaatattt taaatccagt
[1427]aaaaatatga taagattatt tcagaatatg aagaactctg tttgtttttg atgaaaaaac
[1429]aaacaaaaaa aatccaccta acggaatctc aatttaacta acagcggcca aactgagaag
[1431]ttaaatttga gaaggggaaa aggcggattt atacttgtat ttaactatct ccattttaac
[1433]attttattaa accccataca agtgaaaatc ctcttttaca ctgttccttt aggtgatcgc
[1435]ggagggacat tatgagtgaa gtaaacctaa aaggaaatac agatgaatta gtgtattatc
[1437]gacagcaaac cactggaaat aaaatcgcca ggaagagaat caaaaaaggg aaagaagaag
[1439]tttattatgt tgctgaaacg gaagagaaga tatggacaga agagcaaata aaaaactttt
[1441]ctttagacaa atttggtacg catatacctt acatagaagg tcattataca atcttaaata
[1443]attacttctt tgatttttgg ggctattttt taggtgctga aggaattgcg ctctatgctc
[1445]acctaactcg ttatgcatac ggcagcaaag acttttgctt tcctagtcta caaacaatcg
[1447]ctaaaaaaat ggacaagact cctgttacag ttagaggcta cttgaaactg cttgaaaggt
[1449]acggttttat ttggaaggta aacgtccgta ataaaaccaa ggataacaca gaggaatccc
[1451]cgatttttaa gattagacgt aaggttcctt tgctttcaga agaactttta aatggaaacc
[1453]ctaatattga aattccagat gacgaggaag cacatgtaaa gaaggcttta aaaaaggaaa
[1455]aagagggtct tccaaaggtt ttgaaaaaag agcacgatga atttgttaaa aaaatgatgg
[1457]atgagtcaga aacaattaat attccagagg ccttacaata tgacacaatg tatgaagata
[1459]tactcagtaa aggagaaatt cgaaaagaaa tcaaaaaaca aatacctaat cctacaacat
[1461]cttttgagag tatatcaatg acaactgaag aggaaaaagt cgacagtact ttaaaaagcg
[1463]aaatgcaaaa tcgtgtctct aagccttctt ttgatacctg gtttaaaaac actaagatca
[1465]aaattgaaaa taaaaattgt ttattacttg taccgagtga atttgcattt gaatggatta
[1467]agaaaagata tttagaaaca attaaaacag tccttgaaga agctggatat gttttcgaaa
[1469]aaatcgaact aagaaaagtg caataaactg ctgaagtatt tcagcagttt tttttattta
[1471]gaaatagtga aaaaaatata atcagggagg tatcaatatt taatgagtac tgatttaaat
[1473]ttatttagac tggaattaat aattaacacg tagactaatt aaaatttaat gagggataaa
[1475]gaggatacaa aaatattaat ttcaatccct attaaatttt aacaaggggg ggattaaaat
[1477]ttaattagag gtttatccac aagaaaagac cctaataaaa tttttactag ggttataaca
[1479]ctgattaatt tcttaatggg ggagggatta aaatttaatg acaaagaaaa caatctttta
[1481]agaaaagctt ttaaaagata ataataaaaa gagctttgcg attaagcaaa actctttact
[1483]ttttcattga cattatcaaa ttcatcgatt tcaaattgtt gttgtatcat aaagttaatt
[1485]ctgttttgca caaccttttc aggaatataa aacacatctg aggcttgttt tataaactca
[1487]gggtcgctaa agtcaatgta acgtagcata tgatatggta tagcttccac ccaagttagc
[1489]ctttctgctt cttctgaatg tttttcatat acttccatgg gtatctctaa atgattttcc
[1491]tcatgtagca aggtatgagc aaaaagttta tggaattgat agttcctctc tttttcttca
[1493]acttttttat ctaaaacaaa cactttaaca tctgagtcaa tgtaagcata agatgttttt
[1495]ccagtcataa tttcaatccc aaatctttta gacagaaatt ctggacgtaa atcttttggt
[1497]gaaagaattt ttttatgtag caatatatcc gatacagcac cttctaaaag cgttggtgaa
[1499]tagggcattt tacctatctc ctctcatttt gtggaataaa aatagtcata ttcgtccatc
[1501]tacctatcct attatcgaac agttgaactt tttaatcaag gatcagtcct ttttttcatt
[1503]attcttaaac tgtgctctta actttaacaa ctcgatttgt ttttccagat ctcgagggta
[1505]actagcctcg ccgatcccgc aagaggcccg gcagtcaggt ggcacttttc ggggaaatgt
[1507]gcgcggaacc cctatttgtt tatttttcta aatacattca aatatgtatc cgctcatgag
[1509]acaataaccc tgataaatgc ttcaataata ttgaaaaagg aagagtatga gtattcaaca
[1511]tttccgtgtc gcccttattc ccttttttgc ggcattttgc cttcctgttt ttgctcaccc
[1513]agaaacgctg gtgaaagtaa aagatgctga agatcagttg ggtgcacgag tgggttacat
[1515]cgaactggat ctcaacagcg gtaagatcct tgagagtttt cgccccgaag aacgttttcc
[1517]aatgatgagc acttttaaag ttctgctatg tggcgcggta ttatcccgta ttgacgccgg
[1519]gcaagagcaa ctcggtcgcc gcatacacta ttctcagaat gacttggttg agtactcacc
[1521]agtcacagaa aagcatctta cggatggcat gacagtaaga gaattatgca gtgctgccat
[1523]aaccatgagt gataacactg cggccaactt acttctgaca acgatcggag gaccgaagga
[1525]gctaaccgct tttttgcaca acatggggga tcatgtaact cgccttgatc gttgggaacc
[1527]ggagctgaat gaagccatac caaacgacga gcgtgacacc acgatgcctg tagcaatggc
[1529]aacaacgttg cgcaaactat taactggcga actacttact ctagcttccc ggcaacaatt
[1531]aatagactgg atggaggcgg ataaagttgc aggaccactt ctgcgctcgg cccttccggc
[1533]tggctggttt attgctgata aatctggagc cggtgagcgt gggtctcgcg gtatcattgc
[1535]agcactgggg ccagatggta agccctcccg tatcgtagtt atctacacga cggggagtca
[1537]ggcaactatg gatgaacgaa atagacagat cgctgagata ggtgcctcac tgattaagca
[1539]ttggtaactg tcagaccaag tttactcata tatactttag attgatttaa aacttcattt
[1541]ttaatttaaa aggatctagg tgaagatcct ttttgataat ctcatgacca aaatccctta
[1543]acgtgagttt tcgttccact gagcgtcaga ccccgtagaa aagatcaaag gatcttcttg
[1545]agatcctttt tttctgcgcg taatctgctg cttgcaaaca aaaaaaccac cgctaccagc
[1547]ggtggtttgt ttgccggatc aagagctacc aactcttttt ccgaaggtaa ctggcttcag
[1549]cagagcgcag ataccaaata ctgtccttct agtgtagccg tagttaggcc accacttcaa
[1551]gaactctgta gcaccgccta catacctcgc tctgctaatc ctgttaccag tggctgctgc
[1553]cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac cggataaggc
[1555]gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc agcttggagc gaacgaccta
[1557]caccgaactg agatacctac agcgtgagct atgagaaagc gccacgcttc ccgaagggag
[1559]aaaggcggac aggtatccgg taagcggcag ggtcggaaca ggagagcgca cgagggagct
[1561]tccaggggga aacgcctggt atctttatag tcctgtcggg tttcgccacc tctgacttga
[1563]gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg ccagcaacgc
[1565]ggccttttta cggttcctgg ccttttgctg gccttttgct cacatgttct ttcctgcgtt
[1567]atcccctgat tctgtggata accgtattac cgcctttgag tgagctgata ccgctcgccg
[1569]cagccgaacg accgagcgca gcgagtcagt gagcgaggaa gcggaagagc gcccaatacg
[1576]<213> Искусственная последовательность
[1578]<223> Суицидная плазмида
[1580]ttctcatgtt tgacagctta tcatcgataa gctttaatgc ggtagtttat cacagttaaa
[1582]ttgctaacgc agtcaggcac cgtgtatgaa atctaacaat gcgctcatcg tcatcctcgg
[1584]caccgtcacc ctggatgctg taggcatagg cttggttatg ccggtactgc cgggcctctt
[1586]gcgggatatc gtccattccg acagcatcgc cagtcactat ggcgtgctgc tagcgctata
[1588]tgcgttgatg caatttctat gcgcacccgt tctcggagca ctgtccgacc gctttggccg
[1590]ccgcccagtc ctgctcgctt cgctacttgg agccactatc gactacgcga tcatggcgac
[1592]cacacccgtc ctgtggatcc tctacgccgg acgcatcgtg gccggcatca ccggcgccac
[1594]aggtgcggtt gctggcgcct atatcgccga catcaccgat ggggaagatc gggctcgcca
[1596]cttcgggctc atgagcgctt gtttcggcgt gggtatggtg gcaggccccg tggccggggg
[1598]actgttgggc gccatctcct tgcatgcacc attccttgcg gcggcggtgc tcaacggcct
[1600]caacctacta ctgggctgct tcctaatgca ggagtcgcat aagggagagc gtcgaccgat
[1602]gcccttgaga gccttcaacc cagtcagctc cttccggtgg gcgcggggca tgactatcgt
[1604]cgccgcactt atgactgtct tctttatcat gcaactcgta ggacaggtgc cggcagcgct
[1606]ctgggtcatt ttcggcgagg accgctttcg ctggagcgcg acgatgatcg gcctgtcgct
[1608]tgcggtattc ggaatcttgc acgccctcgc tcaagccttc gtcactggtc ccgccaccaa
[1610]acgtttcggc gagaagcagg ccattatcgc cggcatggcg gccgacgcgc tgggctacgt
[1612]cttgctggcg ttcgcgacgc gaggctggat ggccttcccc attatgattc ttctcgcttc
[1614]cggcggcatc gggatgcccg cgttgcaggc catgctgtcc aggcaggtag atgacgacca
[1616]tcagggacag cttcaaggat cgctcgcggc tcttaccagc ctaacttcga tcactggacc
[1618]gctgatcgtc acggcgattt atgccgcctc ggcgagcaca tggaacgggt tggcatggat
[1620]tgtaggcgcc gccctatacc ttgtctgcct ccccgcgttg cgtcgcggtg catggagccg
[1622]ggccacctcg acctgaatgg aagccggcgg cacctcgcta acggattcac cactccaaga
[1624]attggagcca atcaattctt gcggagaact gtgaatgcgc aaaccaaccc ttggcagaac
[1626]atatccatcg cgtccgccat ctccagcagc cgcacgcggc gcatctcggg cagcgttggg
[1628]tcctggccac gggtgcgcat gatcgtgctc ctgtcgttga ggacccggct aggctggcgg
[1630]ggttgcctta ctggttagca gaatgaatca ccgatacgcg agcgaacgtg aagcgactgc
[1632]tgctgcaaaa cgtctgcgac ctgagcaaca acatgaatgg tcttcggttt ccgtgtttcg
[1634]taaagtctgg aaacgcggaa gtcagcgccc tgcaccatta tgttccggat ctgcatcgca
[1636]ggatgctgct ggctaccctg tggaacacct acatctgtat taacgaagcg ctggcattga
[1638]ccctgagtga tttttctctg gtcccgccgc atccataccg ccagttgttt accctcacaa
[1640]cgttccagta accgggcatg ttcatcatca gtaacccgta tcgtgagcat cctctctcgt
[1642]ttcatcggta tcattacccc catgaacaga aatccccctt acacggaggc atcagtgacc
[1644]aaacaggaaa aaaccgccct taacatggcc cgctttatca gaagccagac attaacgctt
[1646]ctggagaaac tcaacgagct ggacgcggat gaacaggcag acatctgtga atcgcttcac
[1648]gaccacgctg atgagcttta ccgcagctgc ctcgcgcgtt tcggtgatga cggtgaaaac
[1650]ctctgacaca tgcagctccc ggagacggtc acagcttgtc tgtaagcgga tgccgggagc
[1652]agacaagccc gtcagggcgc gtcagcgggt gttggcgggt gtcggggcgc agccatgacc
[1654]cagtcacgta gcgatagcgg agtgtatact ggcttaacta tgcggcatca gagcagattg
[1656]tactgagagt gcaccagcgg gcaaggaaag ccttcaatat gtgcagtggt atgtcaactc
[1658]tatgaagatc agcctgttta caatggcagg gtctttgctc tgtgtgacgt ttacggccta
[1660]tgcgttttcg cgctttcggt ttaaagggag gaaatacgct ttaacgctct ttttattgct
[1662]gcagatgatt cctcagtttt cagctttaat tgccttgttt gtgctggcgc aaatcttggg
[1664]aatgatcaat agccactggc tgctaatctt gctttatatc ggcggcctga tcccgatgaa
[1666]tacgtatttg atgaaagggt acatggattc cattccgatg gatttagacg aaagcgccaa
[1668]gattgacgga gccagcagca ccagaatctt cttccagatc attctgccat tatcaaaacc
[1670]gatggcggca gtcgtggcca tgaacggctt taccggtccg ctcggagatt ttgtgctgtc
[1672]ctcaaccata ttgagaacgc ctgaatcata tacattgccc gtcggtctat tcaatttagt
[1674]gaatgatgtc atgggggcca gctatacgac atttgcggcc ggagccctgc ttatcagcat
[1676]accggttgcc gtcatcttta ttatgctgca aaagaatttt gtgtccggat taaccgcagg
[1678]cggaacgaag ggctaagaga acaaggagga gaatgtgatg tcaaagcttg aaaaaacgca
[1680]cgtaacaaaa gcaaaattta tgctccatgg gggagactac aaccccgatc agtggctgga
[1682]tcggcccgat attttagctg acgatatcaa actgatgaag ctttctcata cgaatacgtt
[1684]ttctgtcggc aattttacat ttttagaaat gggcgtgaaa aaaagcgcgc gattatgtaa
[1686]aatataaaga ttaactaata aggaggacaa acatgacaga acagtacatc aaaaacgttg
[1688]aagtgtatct tgattatgca acaatcccga cactgaacta cttttaccat tttacagaaa
[1690]acaaagatga tattgcgaca attagactgt ttggccttgg acgctttaac atctctaaat
[1692]caatcatcga atcatatccg gaaggcatta tcagatattg cccgattatc tttgaagatc
[1694]agacagcttt tcaacagctg tttatcacac tgcttacaga agattctttt tgtcaatacc
[1696]gctttaactt tcatattaac ctgtttcatt catggaaaat gcttatcccg ctgctgcata
[1698]ttatctggca atttaaacat aaagtcctgg atattaaact taacttttat gatgatggct
[1700]ctgaaggact ggttacactg tcaaaaatcg aacaaaacta ttcaagcgaa attcttcaga
[1702]aaatcatcga tattgatagc caatcttttt acgctgataa acttagcttt ttagatgaag
[1704]atattgccag atatttatgg aatagcctgt ttgaatcaca ttactatctt ttaaacgatt
[1706]ttctgcttaa aaacgaaaaa ctgagcttac tgaaaaactc tatcaaatac tgccatatca
[1708]tggatcttga acgctattta caatttacac aggaagaaaa agatttcttt aacgaacttc
[1710]tgggcattaa catccagagc cttgaagata aaatcaaaat ctttcaacaa aagaaaacat
[1712]ttatttttac aggaacaaca atcttttctc tgccgaaaga agaagaagaa acactttaca
[1714]gactgcatct gaacgctatc cttaactaca tccatccgaa cggcaaatac tttatcggcg
[1716]atggatttac actggtgatc aaaggacatc cgcatcaaaa agaaatgaat agcagactgg
[1718]aaaaatcatt tgaaaaagcc gtcatgctgc cggataacat cccgtttgaa attctttacc
[1720]tgatcggctg caaaccggat aaaattggcg gatttgtttc aacaagctac ttttcatgtg
[1722]ataagaaaaa tattgcggat ctgctgttta tcagcgcgag acaggaagaa gtgcgcaaaa
[1724]acgattatct ttttaacatc caataccagc tgagagatat gatgatcaaa acaggattta
[1726]tccaagaaga aaaaacacat ttttacagcg atattccgat ctttatttct taaaaaggag
[1728]gaactactat gtcacttgca attatcccgg cgagaggcgg aagcaaaggc atcaaaaaca
[1730]aaaacctggt tctgcttaac aacaaaccgc ttatctacta cacaatcaaa gcagcgctga
[1732]atgctaaatc tatttcaaaa gttgtggtct caagcgatag cgatgaaatc cttaactacg
[1734]ccaaatctca aaacgtggat attctgaaaa gaccgatctc tcttgcacag gatgatacaa
[1736]catcagataa agtcttactg catgcgctga aattttacaa agattacgaa gatgttgtgt
[1738]ttttacaacc gacatctccg ctgcgcacaa acattcatat caacgaagca tttaacctgt
[1740]acaaaaattc aaacgctaat gccctgatta gcgtctctga atgcgataac aaaatcctta
[1742]aagcatttgt ttgcaacgat tgtggcgatt tagccggaat ttgtaatgat gaatatccgt
[1744]ttatgccgcg ccagaaactg ccgaaaacat atatgagcaa cggagcgatc tacatcctta
[1746]aaatcaaaga atttctgaac aacccgtcat ttctgcaaag caaaacaaaa cattttctta
[1748]tggatgaatc atcatcactg gatattgatt gcctggaaga tttaaagaaa gttgaacaaa
[1750]tttggaaaaa ataagctctt aaggaggatt ttagaatgag cacaacaaca caaaatatcc
[1752]cgtggtatcg ccatcttaac agagcccagt ggcgcgcatt ttctgcagcg tggttaggct
[1754]atctgcttga tggatttgat tttgttctga ttgcactggt tcttacagaa gtgcaaggcg
[1756]aatttggact tacaacagtg caggctgcct ctttaatttc agcagcgttt atcagcagat
[1758]ggtttggcgg attaatgctg ggcgcaatgg gagatcgcta tggaagacgc ctggcgatgg
[1760]tcacatctat tgttctgttt tcagcgggca cattagcttg cggctttgcc ccgggatata
[1762]ttacaatgtt tatcgcgaga cttgtgattg gcatgggaat ggcaggcgaa tatggatcaa
[1764]gcgcgacgta tgttatcgaa tcttggccga aacatctgcg caataaagca tcaggatttc
[1766]ttattagcgg cttttctgtg ggagcggttg tggctgccca agtctattct cttgtcgttc
[1768]cggtttgggg atggagagca ctgtttttca ttggcatcct tccgattatc tttgctcttt
[1770]ggttacgcaa aaatatcccg gaagccgaag attggaaaga aaaacatgcc ggaaaagcac
[1772]ctgtgagaac aatggtcgat attctgtata gaggcgaaca tcgcattgct aacatcgtta
[1774]tgacattagc agcggctaca gctctgtggt tttgctttgc cggaaattta caaaacgccg
[1776]caatcgttgc tgtgctgggc ttactgtgtg cggctatttt tatcagcttt atggttcagt
[1778]ctgccggaaa acgctggccg acaggcgtga tgttaatggt ggtcgttctg tttgcttttc
[1780]tttattcatg gccgattcaa gcccttttac cgacatacct gaaaacagat ttagcttaca
[1782]atccgcatac agtggccaac gtcctgtttt tctcaggctt tggagccgca gttggctgct
[1784]gtgtgggcgg atttcttggc gattggttag gaacaagaaa agcgtatgtt tgttcactgc
[1786]ttgcgagcca gttactgatt atcccggttt ttgcaatcgg cggagcgaat gtctgggttc
[1788]ttggactttt actgtttttc caacagatgt taggccaagg aattgctggc atcttaccga
[1790]aactgattgg cggatatttt gatacagatc agagagcggc tggccttgga tttacatata
[1792]atgttggagc actgggcgga gcccttgcac cgattatcgg agcgttaatt gctcaacgcc
[1794]tggatcttgg cacagcgctt gcttctttat catttagcct gacatttgtg gtcattcttt
[1796]taatcggcct tgatatgccg tcaagagttc agcgctggtt aagaccggaa gcactgagaa
[1798]cacatgatgc gattgatggc aaaccgtttt caggagctgt gccgtttggc agcgccaaaa
[1800]acgatctggt caaaacaaaa tcataaccag gcatcaaata aaacgaaagg ctcagtcgaa
[1802]agactgggcc tttcgtttta tctgttgttt gtcggtgaac gctctctact agagtcacac
[1804]tggctcacct tcgggtgggc ctttctgcgt ttatatacgc gttaacccgg gcccgcggat
[1806]ggatatgatc agatccttta actctggcaa ccctcaaaat tgaatgagac atgctacacc
[1808]tccggataat aaatatatat aaacgtatat agatttcata aagtctaaca cactagactt
[1810]atttacttcg taattaagtc gttaaaccgt gtgctctacg accaaaacta taaaaccttt
[1812]aagaactttc tttttttaca agaaaaaaga aattagataa atctctcata tcttttattc
[1814]aataatcgca tccgattgca gtataaattt aacgatcact catcatgttc atatttatca
[1816]gagctcgtgc tataattata ctaattttat aaggaggaaa aaatatgggc atttttagta
[1818]tttttgtaat cagcacagtt cattatcaac caaacaaaaa ataagtggtt ataatgaatc
[1820]gttaataagc aaaattcata taaccaaatt aaagagggtt ataatgaacg agaaaaatat
[1822]aaaacacagt caaaacttta ttacttcaaa acataatata gataaaataa tgacaaatat
[1824]aagattaaat gaacatgata atatctttga aatcggctca ggaaaaggcc attttaccct
[1826]tgaattagta aagaggtgta atttcgtaac tgccattgaa atagaccata aattatgcaa
[1828]aactacagaa aataaacttg ttgatcacga taatttccaa gttttaaaca aggatatatt
[1830]gcagtttaaa tttcctaaaa accaatccta taaaatatat ggtaatatac cttataacat
[1832]aagtacggat ataatacgca aaattgtttt tgatagtata gctaatgaga tttatttaat
[1834]cgtggaatac gggtttgcta aaagattatt aaatacaaaa cgctcattgg cattactttt
[1836]aatggcagaa gttgatattt ctatattaag tatggttcca agagaatatt ttcatcctaa
[1838]acctaaagtg aatagctcac ttatcagatt aagtagaaaa aaatcaagaa tatcacacaa
[1840]agataaacaa aagtataatt atttcgttat gaaatgggtt aacaaagaat acaagaaaat
[1842]atttacaaaa aatcaattta acaattcctt aaaacatgca ggaattgacg atttaaacaa
[1844]tattagcttt gaacaattct tatctctttt caatagctat aaattattta ataagtaagc
[1846]gaggcaggat caggacaatg attatatttt tgtcatgaat ttcacggaag aaaaacagct
[1848]ggtcacgttt gatcagagtg tgaaggacat aatgacagga gacatattgt caggcgacct
[1850]gacgatggaa aagtatgaag tgagaattgt cgtaaacaca cattaggctg atgctccgct
[1852]cgatatgggc ggattctttt ttctatagaa tgaaaacgct tgctaagtct tggggggatg
[1854]aaatcatgaa aagcaaagtg aaaatgttct ttgcggctgc catcgtgtgg agtgcatgta
[1856]gttcaacagg atatgccgct gccattgaga aggagaagca cgtgtcagag cttcgggcag
[1858]aggatctttt tgttaaaaaa gtagagggga tgaacaagga ttttatcaaa ggggcagatg
[1860]tatccagcgt tattgctttg gaaaacagcg gtgtcacctt ttacaataca aacggaaaac
[1862]gccaggatat ctttacaact ttaaaacagg ctggggtcaa ctatgttcgc gtccgcatct
[1864]ggaatcaccc gtatgattca aatggcaacg ggtatggcgg gggaaacaat gatgttcaaa
[1866]aagccatcga aatcggaaaa agagcgacag cgaacggaat gaaggtgctg gccgactttc
[1868]actactctga tttctgggcc gatccagcga aacaaaaggt gcccaaagcc tgggcgaatc
[1870]tcagctttga agcaaaaaaa gcaaagctct atgagtatac gaaacaaagc ctgcaaaaga
[1872]tgatcaagga aggcgtgcgg tgtgaaatac cgcacagatg cgtaaggaga aaataccgca
[1874]tcaggcgctc ttccgcttcc tcgctcactg actcgctgcg ctcggtcgtt cggctgcggc
[1876]gagcggtatc agctcactca aaggcggtaa tacggttatc cacagaatca ggggataacg
[1878]caggaaagaa catgtgagca aaaggccagc aaaaggccag gaaccgtaaa aaggccgcgt
[1880]tgctggcgtt tttccatagg ctccgccccc ctgacgagca tcacaaaaat cgacgctcaa
[1882]gtcagaggtg gcgaaacccg acaggactat aaagatacca ggcgtttccc cctggaagct
[1884]ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg atacctgtcc gcctttctcc
[1886]cttcgggaag cgtggcgctt tctcatagct cacgctgtag gtatctcagt tcggtgtagg
[1888]tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt tcagcccgac cgctgcgcct
[1890]tatccggtaa ctatcgtctt gagtccaacc cggtaagaca cgacttatcg ccactggcag
[1892]cagccactgg taacaggatt agcagagcga ggtatgtagg cggtgctaca gagttcttga
[1894]agtggtggcc taactacggc tacactagaa ggacagtatt tggtatctgc gctctgctga
[1896]agccagttac cttcggaaaa agagttggta gctcttgatc cggcaaacaa accaccgctg
[1898]gtagcggtgg tttttttgtt tgcaagcagc agattacgcg cagaaaaaaa ggatctcaag
[1900]aagatccttt gatcttttct acggggtctg acgctcagtg gaacgaaaac tcacgttaag
[1902]ggattttggt catgagatta tcaaaaagga tcttcaccta gatcctttta aattaaaaat
[1904]gaagttttaa atcaatctaa agtatatatg agtaaacttg gtctgacagt taccaatgct
[1906]taatcagtga ggcacctatc tcagcgatct gtctatttcg ttcatccata gttgcctgac
[1908]tccccgtcgt gtagataact acgatacggg agggcttacc atctggcccc agtgctgcaa
[1910]tgataccgcg agacccacgc tcaccggctc cagatttatc agcaataaac cagccagccg
[1912]gaagggccga gcgcagaagt ggtcctgcaa ctttatccgc ctccatccag tctattaatt
[1914]gttgccggga agctagagta agtagttcgc cagttaatag tttgcgcaac gttgttgcca
[1916]ttgctgcagg catcgtggtg tcacgctcgt cgtttggtat ggcttcattc agctccggtt
[1918]cccaacgatc aaggcgagtt acatgatccc ccatgttgtg caaaaaagcg gttagctcct
[1920]tcggtcctcc gatcgttgtc agaagtaagt tggccgcagt gttatcactc atggttatgg
[1922]cagcactgca taattctctt actgtcatgc catccgtaag atgcttttct gtgactggtg
[1924]agtactcaac caagtcattc tgagaatagt gtatgcggcg accgagttgc tcttgcccgg
[1926]cgtcaacacg ggataatacc gcgccacata gcagaacttt aaaagtgctc atcattggaa
[1928]aacgttcttc ggggcgaaaa ctctcaagga tcttaccgct gttgagatcc agttcgatgt
[1930]aacccactcg tgcacccaac tgatcttcag catcttttac tttcaccagc gtttctgggt
[1932]gagcaaaaac aggaaggcaa aatgccgcaa aaaagggaat aagggcgaca cggaaatgtt
[1934]gaatactcat actcttcctt tttcaatatt attgaagcat ttatcagggt tattgtctca
[1936]tgagcggata catatttgaa tgtatttaga aaaataaaca aataggggtt ccgcgcacat
[1938]ttccccgaaa agtgccacct gacgtctaag aaaccattat tatcatgaca ttaacctata
[1940]aaaataggcg tatcacgagg ccctttcgtc ttcaagaa
[1945]<213> Искусственная последовательность
[1947]<223> Интерграционная кассета
[1949]gcaggctgtt attgtaacat gtaagccata agccattcgt aaaagtgcgg gaggaaggtc
[1951]atgaataatc tgcgtaatag actttcaggc gtgaatggga aaaataagag agtaaaagaa
[1953]aaagaacaaa aaatctggtc ggagattggg atgatagcgg gagcatttgc gctgcttgat
[1955]gtgatcatcc gcggcattat gtttgaattt ccgtttaaag aatgggctgc aagccttgtg
[1957]tttttgttca tcattatctt atattactgc atcagggctg cggcatccgg aatgctcatg
[1959]ccgagaatag acaccaaaga agaactgcaa aaacgggtga agcagcagcg aatagaatca
[1961]attgcggtcg cctttgcggt agtggtgctt acgatgtacg acagggggat tccccataca
[1963]ttcttcgctt ggctgaaaat gattcttctt tttatcgtct gcggcggcgt tctgtttctg
[1965]cttcggtatg tgattgtgaa gctggcttac agaagagcgg taaaagaaga aataaaaaag
[1967]aaatcatctt ttttgtttgg aaagcgaggg aagcgttcac agtttcgggc agcttttttt
[1969]ataggaacat tgatttgtat tcactctgcc aagttgtttt gatagagtga ttgtgataat
[1971]tttaaatgta agcgttaaca aaattctcca gtcttcacat cggtttgaaa ggaggaagcg
[1973]gaagaatgaa gtaagaggga tttttgactc cgaagtaagt cttcaaaaaa tcaaataagg
[1975]agtgtcaaga atgtttgcaa aacgattcaa aacctcttta ctgccgttat tcgctggatt
[1977]tttattgctg tttcatttgg ttctggcagg accggcggct gcgagtgctg aaacggcgaa
[1979]caaatcgaat gagcttacag caccgtcgat caaaagcgga accattcttc atgcatggcc
[1981]agtgaattcg agctcggtac ctaccgttcg tataatgtat gctatacgaa gttatgataa
[1983]aaaatttaga agccaatgaa atctataaat aaactaaatt aagtttattt aattaacaac
[1985]tatggatata aaataggtac taatcaaaat agtgaggagg atatatttga atacatacga
[1987]acaaattaat aaagtgaaaa aaatacttcg gaaacattta aaaaataacc ttattggtac
[1989]ttacatgttt ggatcaggag ttgagagtgg actaaaacca aatagtgatc ttgacttttt
[1991]agtcgtcgta tctgaaccat tgacagatca aagtaaagaa atacttatac aaaaaattag
[1993]acctatttca aaaaaaatag gagataaaag caacttacga tatattgaat taacaattat
[1995]tattcagcaa gaaatggtac cgtggaatca tcctcccaaa caagaattta tttatggaga
[1997]atggttacaa gagctttatg aacaaggata cattcctcag aaggaattaa attcagattt
[1999]aaccataatg ctttaccaag caaaacgaaa aaataaaaga atatacggaa attatgactt
[2001]agaggaatta ctacctgata ttccattttc tgatgtgaga agagccatta tggattcgtc
[2003]agaggaatta atagataatt atcaggatga tgaaaccaac tctatattaa ctttatgccg
[2005]tatgatttta actatggaca cgggtaaaat cataccaaaa gatattgcgg gaaatgcagt
[2007]ggctgaatct tctccattag aacataggga gagaattttg ttagcagttc gtagttatct
[2009]tggagagaat attgaatgga ctaatgaaaa tgtaaattta actataaact atttaaataa
[2011]cagattaaaa aaattataaa aaaattgaaa aaatggtgga aacacttttt tcaatttttt
[2013]tgttttatta tttaatattt gggaaatatt cattctaata taacttcgta taatgtatgc
[2015]tatacgaacg gtaggatcct ctagagtcga cctgcaggca ttttacattt ttagaaatgg
[2017]gcgtgaaaaa aagcgcgcga ttatgtaaaa tataaagtga tagcggtacc attataggta
[2019]agagaggaat gtacacatgt actatttaaa aaacacaaac ttttggatgt tcggtttatt
[2021]ctttttcttt tactttttta tcatgggagc ctacttcccg tttttcccga tttggctaca
[2023]tgacatcaac catatcagca aaagtgatac gggtattatt tttgccgcta tttctctgtt
[2025]ctcgctatta ttccaaccgc tgtttggtct gctttctgac aaactcgggc tgcgcaaata
[2027]cctgctgtgg attattaccg gcatgttagt gatgtttgcg ccgttcttta tttttatctt
[2029]cgggccactg ttacaataca acattttagt aggatcgatt gttggtggta tttatctagg
[2031]cttttgtttt aacgccggtg cgccagcagt agaggcattt attgagaaag tcagccgtcg
[2033]cagtaatttc gaatttggtc gcgcgcggat gtttggctgt gttggctggg cgctgtgtgc
[2035]ctcgattgtc ggcatcatgt tcaccatcaa taatcagttt gttttctggc tgggctctgg
[2037]ctgtgcactc atcctcgccg ttttactctt tttcgccaaa acggatgcgc cctcttctgc
[2039]cacggttgcc aatgcggtag gtgccaacca ttcggcattt agccttaagc tggcactgga
[2041]actgttcaga cagccaaaac tgtggttttt gtcactgtat gttattggcg tttcctgcac
[2043]ctacgatgtt tttgaccaac agtttgctaa tttctttact tcgttctttg ctaccggtga
[2045]acagggtacg cgggtatttg gctacgtaac gacaatgggc gaattactta acgcctcgat
[2047]tatgttcttt gcgccactga tcattaatcg catcggtggg aaaaacgccc tgctgctggc
[2049]tggcactatt atgtctgtac gtattattgg ctcatcgttc gccacctcag cgctggaagt
[2051]ggttattctg aaaacgctgc atatgtttga agtaccgttc ctgctggtgg gctgctttaa
[2053]atatattacc agccagtttg aagtgcgttt ttcagcgacg atttatctgg tctgtttctg
[2055]cttctttaag caactggcga tgatttttat gtctgtactg gcgggcaata tgtatgaaag
[2057]catcggtttc cagggcgctt atctggtgct gggtctggtg gcgctgggct tcaccttaat
[2059]ttccgtgttc acgcttagcg gccccggccc gctttccctg ctgcgtcgtc aggtgaatga
[2061]agtcgcttaa gcaatcaatg tcggatgcca gcctggcttt gattacgtgc taaatggttt
[2063]atataatgac tcgggcttaa gcggttctct tccccattga gggcaaggct agacgggact
[2065]taccgaaaga aaccatcaat gatggtttct tttttgttca taaatcagac aaaacttttc
[2067]tcttgcaaaa gtttgtgaag tgttgcacaa tataaatgtg aaatacttca caaacaaaaa
[2069]gacatcaaag agaaacatac cctggaagga tgattaatga tgaacaaaca tgtaaataaa
[2071]gtagctttaa tcggagcggg ttttgttgga agcagttatg catttgcgtt aattaaccaa
[2073]ggaatcacag atgagcttgt ggtcattgat gtaaataaag aaaaagcaat gggcgatgtg
[2075]atggatttaa accacggaaa ggcgtttgcg ccacaaccgg tcaaaacatc ttacggaaca
[2077]tatgaagact gcaaggatgc tgatattgtc tgcatttgcg ccggagcaaa ccaaaaacct
[2079]ggtgagacac gccttgaatt agtagaaaag aacttgaaga ttttcaaagg catcgttagt
[2081]gaagtcatgg cgagcggatt tgacggcatt ttcttagtcg cgacaaatcc ggttgatatc
[2083]ctgacttacg caacatggaa attcagcggc ctgccaaaag agcgggtgat tggaagcggc
[2085]acaacacttg attctgcgag attccgtttc atgctgagcg aatactttgg cgcagcgcct
[2087]caaaacgtac acgcgcatat tatcggagag cacggcgaca cagagcttcc tgtttggagc
[2089]cacgcgaatg tcggcggtgt gccggtcagt gaactcgttg agaaaaacga tgcg


 ) и гены comK и comS, в геном В. subtilis. Дополнительно, данная стратегия обеспечивает трансформацию В. subtilis за счет природной компетентности с использованием сложной среды (например, LB).
) и гены comK и comS, в геном В. subtilis. Дополнительно, данная стратегия обеспечивает трансформацию В. subtilis за счет природной компетентности с использованием сложной среды (например, LB).

 ) и синтазы N-ацетилнейраминовой кислоты (тоже самое, что синтаза сиаловой кислоты) (Фиг. 1:
) и синтазы N-ацетилнейраминовой кислоты (тоже самое, что синтаза сиаловой кислоты) (Фиг. 1:  ). Следовательно, в клетке Bacillus для получения сиалированного олигосахарида есть глутамин:фруктозо-6-фосфатаминотрансфераза и синтаза N-ацетилнейраминовой кислоты.
). Следовательно, в клетке Bacillus для получения сиалированного олигосахарида есть глутамин:фруктозо-6-фосфатаминотрансфераза и синтаза N-ацетилнейраминовой кислоты. ). Обычно считается, что данная ферментативная реакция является первой стадией пути биосинтеза гексозамина. Альтернативными названиями глутамин:фруктозо-6-фосфатаминотрансферазы являются D-фруктозо-6-фосфатаминотрансфераза, GFAT, глюкозамин-6-фосфатсинтаза, гексозофосфатаминотрансфераза и L-глутамин-D-фруктозо-6-фосфатаминотрансфераза.
). Обычно считается, что данная ферментативная реакция является первой стадией пути биосинтеза гексозамина. Альтернативными названиями глутамин:фруктозо-6-фосфатаминотрансферазы являются D-фруктозо-6-фосфатаминотрансфераза, GFAT, глюкозамин-6-фосфатсинтаза, гексозофосфатаминотрансфераза и L-глутамин-D-фруктозо-6-фосфатаминотрансфераза. ). Ферментативное образование NeuNAc представляет собой последнюю стадию пути биосинтеза сиаловой кислоты.
). Ферментативное образование NeuNAc представляет собой последнюю стадию пути биосинтеза сиаловой кислоты. ), глюкозамин-1-фосфат N-ацетилтрансфераза (Фиг. 1:
), глюкозамин-1-фосфат N-ацетилтрансфераза (Фиг. 1:  ), N-ацетилглюкозамин-1-фосфатуридилтрансфераза (Фиг. 1
), N-ацетилглюкозамин-1-фосфатуридилтрансфераза (Фиг. 1  ) и УДФ-N-ацетилглюкозамин 2-эпимераза (Фиг. 1:
) и УДФ-N-ацетилглюкозамин 2-эпимераза (Фиг. 1:  ). С-концевой домен катализирует перенос ацетильной группы с ацетил-коэнзима А на глюкозамин-1-фосфат (GlcN-1-P) с получением N-ацетилглюкозамин-1-фосфата (GlcNAc-1-P), который превращается в УДФ-GlcNAc посредством переноса уридин-5-монофосфата (с уридин 5-трифосфата), реакция, катализируемая N-концевым доменом.
). С-концевой домен катализирует перенос ацетильной группы с ацетил-коэнзима А на глюкозамин-1-фосфат (GlcN-1-P) с получением N-ацетилглюкозамин-1-фосфата (GlcNAc-1-P), который превращается в УДФ-GlcNAc посредством переноса уридин-5-монофосфата (с уридин 5-трифосфата), реакция, катализируемая N-концевым доменом. ).
). ). В пути биосинтеза сиаловой кислоты, использующем глюкозамин-6-фосфат-N-ацетилтрансферазу для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты, не используется УДФ-GlcNAc для биосинтеза сиаловой кислоты.
). В пути биосинтеза сиаловой кислоты, использующем глюкозамин-6-фосфат-N-ацетилтрансферазу для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты, не используется УДФ-GlcNAc для биосинтеза сиаловой кислоты. ) и синтазы N-ацетилнейраминовой кислоты (Фиг. 1:
) и синтазы N-ацетилнейраминовой кислоты (Фиг. 1:  ). Указанный путь биосинтеза сиаловой кислоты дополнительно включает а) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:
). Указанный путь биосинтеза сиаловой кислоты дополнительно включает а) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:  ) и N-ацетилглюкозамин-2-эпимеразы (Фиг. 1:
) и N-ацетилглюкозамин-2-эпимеразы (Фиг. 1:  ) или b) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:
) или b) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:  ), N-ацетилглюкозамин-6-фосфатэпимеразы (Фиг. 1:
), N-ацетилглюкозамин-6-фосфатэпимеразы (Фиг. 1:  ) и N-ацетилманнозамин-6-фосфатфосфатазы (Фиг. 1:
) и N-ацетилманнозамин-6-фосфатфосфатазы (Фиг. 1:  ). Таким образом, необязательно, чтобы генетически сконструированная клетка Bacillus обладала ферментативными активностями фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ-N-ацетилглюкозамин 2-эпимеразы с сопутствующим высвобождением УДФ для внутриклеточного биосинтеза сиаловой кислоты. Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus, способная синтезировать сиаловую кислоту, не содержит одной или более активностей ферментов, выбранных из группы, состоящей из активностей ферментов фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ N-ацетилглюкозамин-2-эпимеразы с сопутствующим высвобождением УДФ.
). Таким образом, необязательно, чтобы генетически сконструированная клетка Bacillus обладала ферментативными активностями фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ-N-ацетилглюкозамин 2-эпимеразы с сопутствующим высвобождением УДФ для внутриклеточного биосинтеза сиаловой кислоты. Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus, способная синтезировать сиаловую кислоту, не содержит одной или более активностей ферментов, выбранных из группы, состоящей из активностей ферментов фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ N-ацетилглюкозамин-2-эпимеразы с сопутствующим высвобождением УДФ. ) для переноса цитидин-5'-монофосфата на N-ацетилнейраминовую кислоту с образованием СМР-активированной N-ацетилнейраминовой кислоты (CMP-NeuNAc). Несколько синтетаз 5'-монофосфо-(СМР)-сиаловой кислоты известны в данной области и описаны, например, синтетазы 5'-монофосфо-(СМР)-сиаловой кислоты из Е. coli, Neisseria meningitidis, Campylobacter jejuni, Streptococcus sp.и т.д.
) для переноса цитидин-5'-монофосфата на N-ацетилнейраминовую кислоту с образованием СМР-активированной N-ацетилнейраминовой кислоты (CMP-NeuNAc). Несколько синтетаз 5'-монофосфо-(СМР)-сиаловой кислоты известны в данной области и описаны, например, синтетазы 5'-монофосфо-(СМР)-сиаловой кислоты из Е. coli, Neisseria meningitidis, Campylobacter jejuni, Streptococcus sp.и т.д.




 и/или Р43. Экспрессионный вектор рНТ253 В. subtilis (MoBiTec GmbH, Göttingen, Германия) использовали в качестве каркаса плазмиды. Каждый ген в пределах экспрессионной кассеты был связан с последовательностью RBS В. subtilis. Дополнительно, подходящую терминирующую последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) помещали ниже экспрессионной кассеты.
и/или Р43. Экспрессионный вектор рНТ253 В. subtilis (MoBiTec GmbH, Göttingen, Германия) использовали в качестве каркаса плазмиды. Каждый ген в пределах экспрессионной кассеты был связан с последовательностью RBS В. subtilis. Дополнительно, подходящую терминирующую последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) помещали ниже экспрессионной кассеты.
