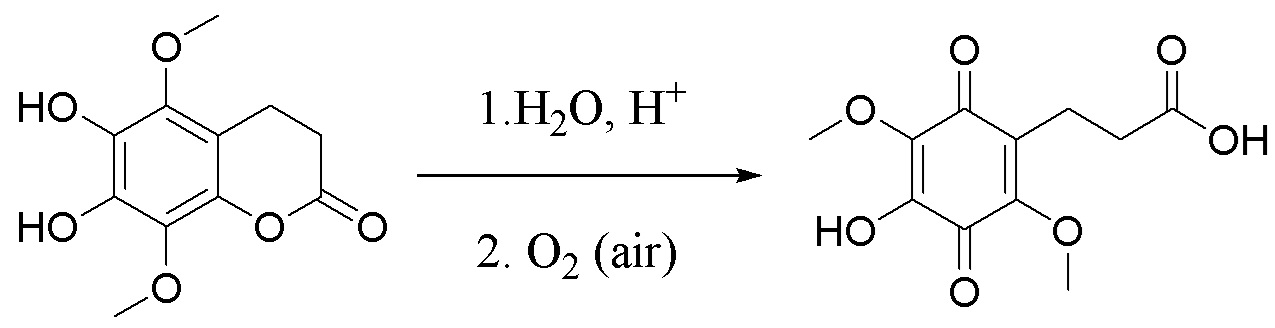Инвестиции
Стартапам
Инвесторам
Инвесторам
Аналитика
Инвестиции
Стартапам
Инвесторам
Аналитика
Спрос и кооперация
Спрос и кооперация
Развитие и продвижение бизнеса
Спрос
Кооперация
Спрос и кооперация
Развитие и продвижение бизнеса
Спрос
Кооперация
Гранты и кредиты
Гранты и кредиты
Инфраструктура
Инфраструктура
Современные пространства
для бизнеса
для бизнеса
Инфраструктура
Современные пространства
для бизнеса
для бизнеса
Патентование
Патентование
Обучение и карьера
Обучение и карьера
Проекты для мегаполиса
Проекты для мегаполиса
Технологические городские проекты
Проекты для мегаполиса
О Кластере
О Кластере
Лидеры цифровой трансформации
Лидеры цифровой трансформации
Академия инноваторов
Академия инноваторов
Новатор Москвы
Новатор Москвы
Обучение и карьера
Обучение и карьера
Образовательные программы и база знаний
Обучение
Обучение и карьера
Образовательные программы и база знаний


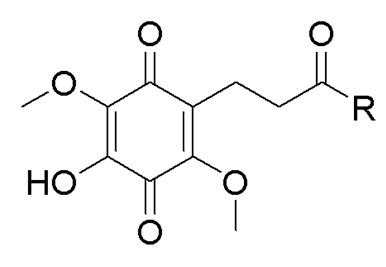 , где R выбран из:
, где R выбран из: 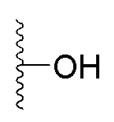 ,
,  ,
,  ,
,  ,
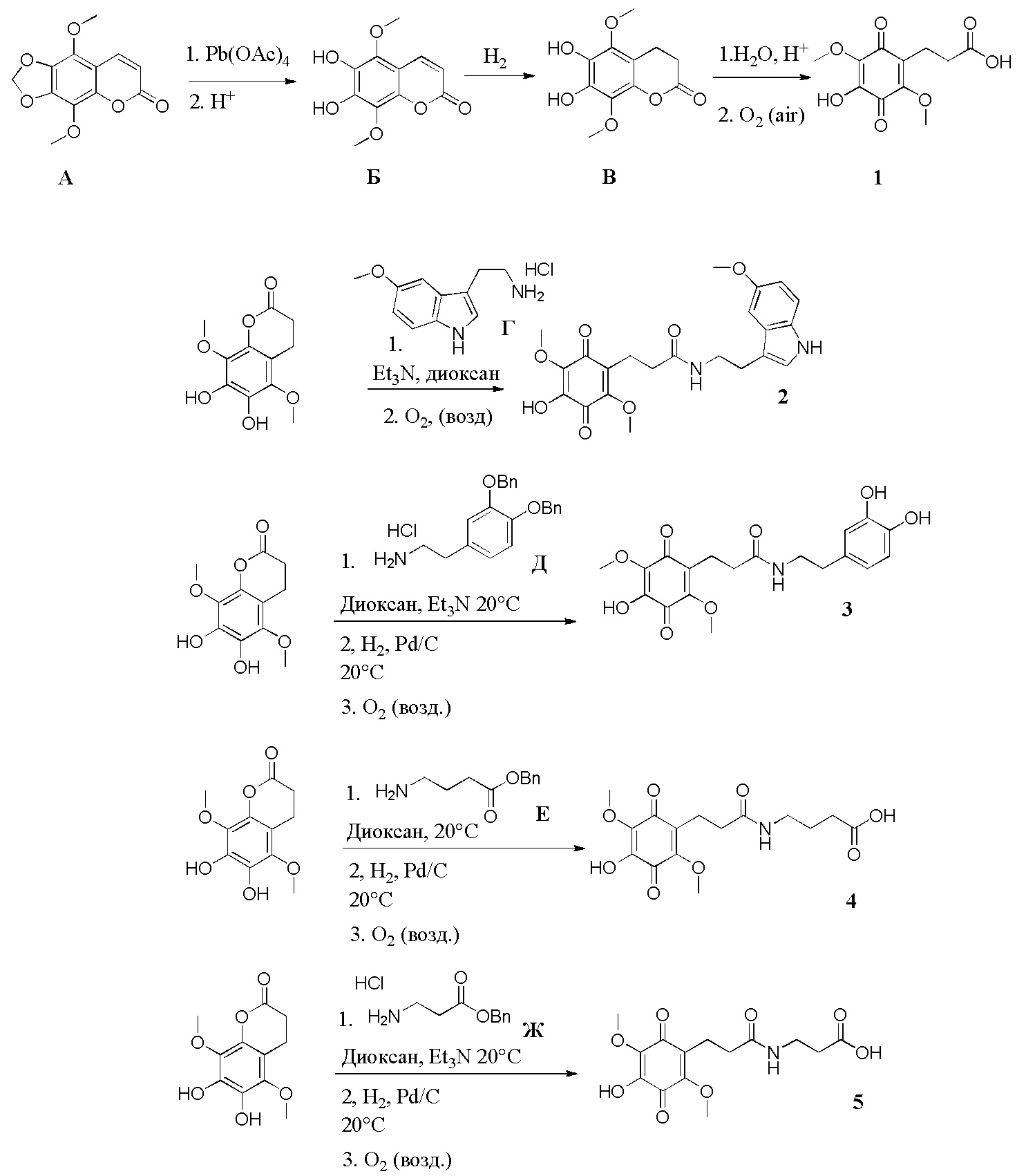
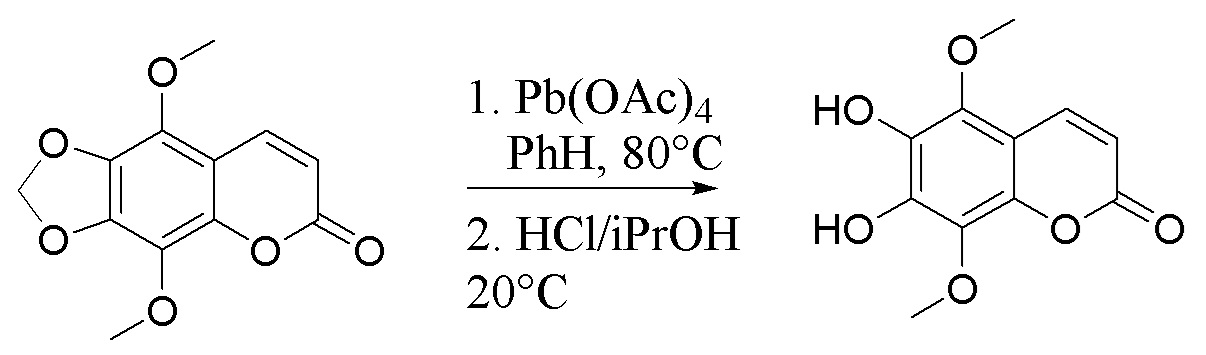
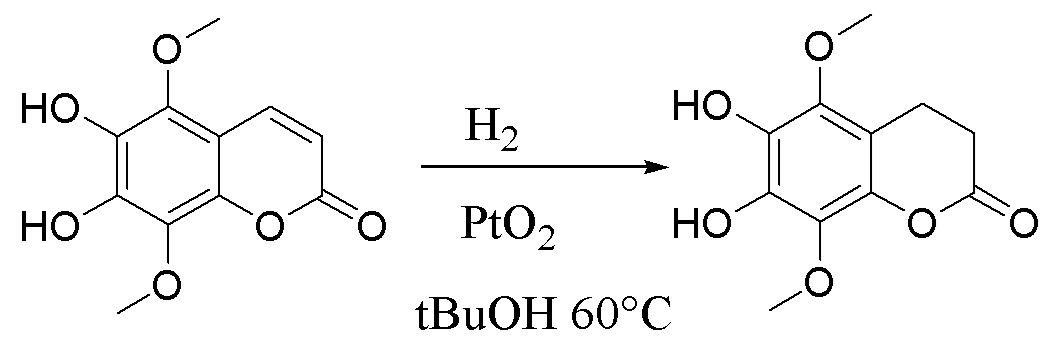
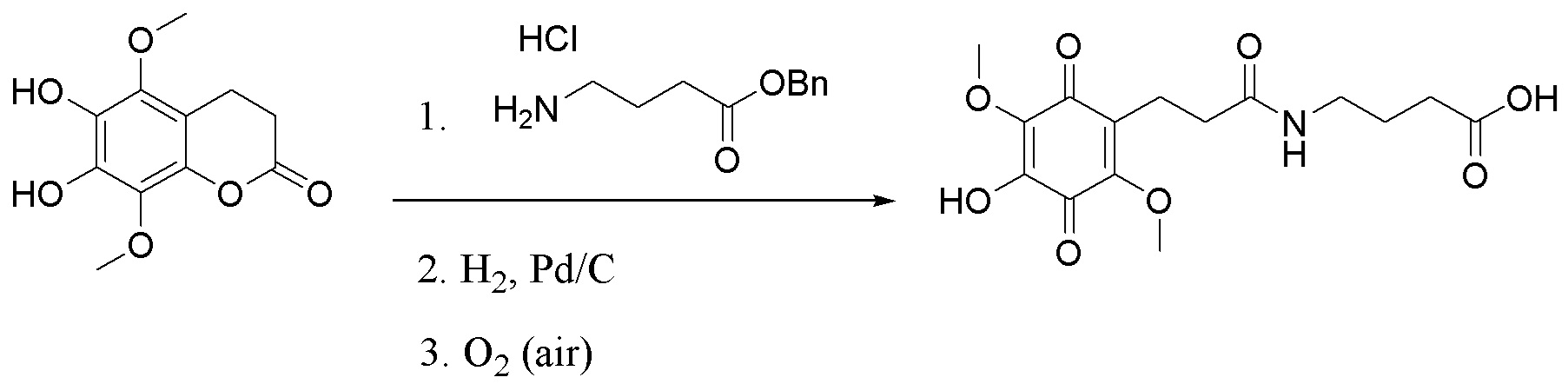
, . Способ осуществляют путем обработки 5,8-диметокси-6,7-метилендиоксикумарина формулы А тетраацетатом свинца, а затем избытком HCl/iPrOH, после чего проводят каталитическое гидрирование полученного дигидроксикумарина формулы Б в атмосфере водорода с получением 6,7-дигидрокси-5,8-диметоксихроман-2-она (В), согласно схеме:
. Способ осуществляют путем обработки 5,8-диметокси-6,7-метилендиоксикумарина формулы А тетраацетатом свинца, а затем избытком HCl/iPrOH, после чего проводят каталитическое гидрирование полученного дигидроксикумарина формулы Б в атмосфере водорода с получением 6,7-дигидрокси-5,8-диметоксихроман-2-она (В), согласно схеме: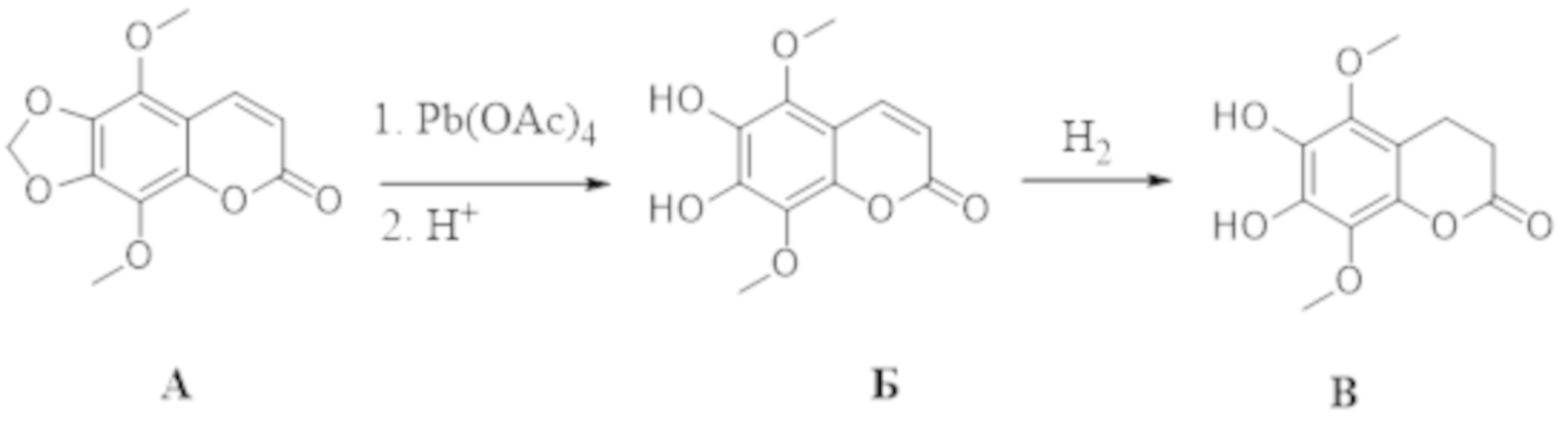 . Затем проводят гидролиз соединения формулы В с последующим окислением кислородом воздуха и получением производных 5,8-диметокси-6,7-метилендиоксикумарина. Технический результат: синтез производных 5,8-диметокси-6,7-метилендиоксикумарина, проявляющих антирадикальную активность. 5 з.п. ф-лы, 2 ил., 1 табл., 9 пр.
. Затем проводят гидролиз соединения формулы В с последующим окислением кислородом воздуха и получением производных 5,8-диметокси-6,7-метилендиоксикумарина. Технический результат: синтез производных 5,8-диметокси-6,7-метилендиоксикумарина, проявляющих антирадикальную активность. 5 з.п. ф-лы, 2 ил., 1 табл., 9 пр.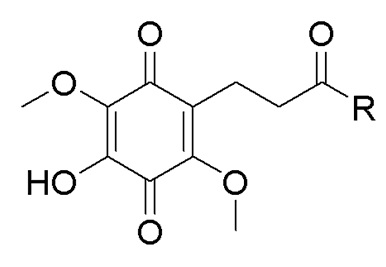
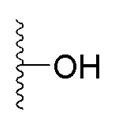 ,
,  ,
,  ,
,  ,
, 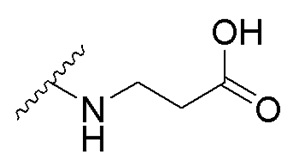 , характеризующийся тем, что исходное соединение 5,8-диметокси-6,7-метилендиоксикумарин (А) обрабатывают тетраацетатом свинца, а затем избытком HCl/iPrOH, после чего проводят каталитическое гидрирование полученного дигидроксикумарина (Б) в атмосфере водорода с получением 6,7-дигидрокси-5,8-диметоксихроман-2-она (В), согласно схеме:
, характеризующийся тем, что исходное соединение 5,8-диметокси-6,7-метилендиоксикумарин (А) обрабатывают тетраацетатом свинца, а затем избытком HCl/iPrOH, после чего проводят каталитическое гидрирование полученного дигидроксикумарина (Б) в атмосфере водорода с получением 6,7-дигидрокси-5,8-диметоксихроман-2-она (В), согласно схеме: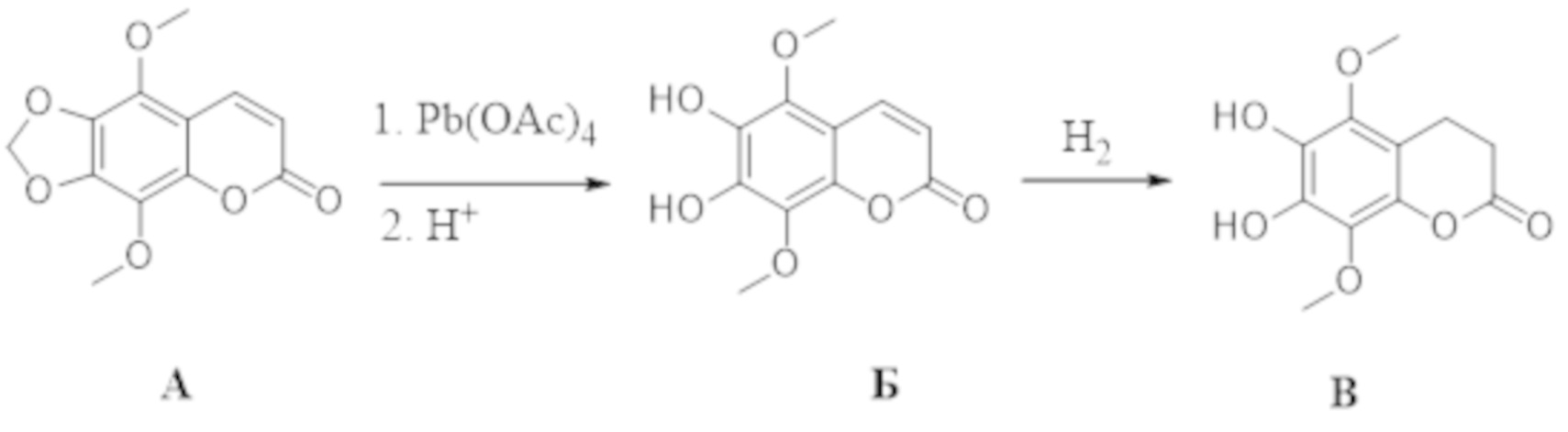 ,
,

 в которой R1 - водород или С1-С6-алкил, R2 - остаток ОТ1 или R3 - остаток ОТ2, R4 - водород или C1-C6-алкил, T1 и T2, которые могут быть одинаковыми или разными, и каждый означает водород, C1- C6-алкил, C1-C6--алконоил, или T1 и T2 совместно с атомами, к которым они присоединены, образуют 5-7-членное гетероциклическое кольцо, которое при желании может быть замещено оксо или тиоксо, или Q - атом кислорода X - атом серы или NH -группу, Y - валентная связь, C1-C6-алкиленовый остаток, который при желании может быть замещен гидроксигруппой или аминогруппой, фениленовый остаток, который при желании может быть одно- или многократно замещен гидроксилом, галогеном, C1-C6-алкилом или карбоксилом, Z - водород, галоген, карбоксил гидроксиметил, C1-C6-алкоксикарбонил, циано или группу NR5R6, причем R5 и R6 совместно с атомом азота, к которому они присоединены, образуют 3-7-членное гетероциклическое кольцо, которое при желании может быть замещено оксо, гидрокси или C1-C6-алкокси, их таутомеры, а также их соли с нетоксическими кислотами или основаниями. Данные представители кумарина из ингибируют pla2 в зависимости от дозы и до 100% и тем самым превосходят известные противовоспалительные соединения (RU2133745, 27.07.1999).
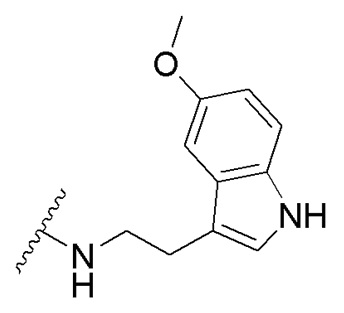
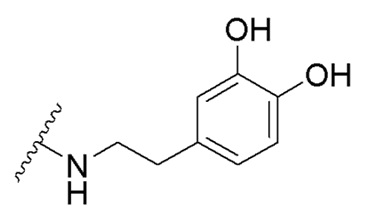
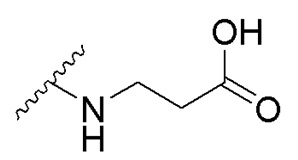
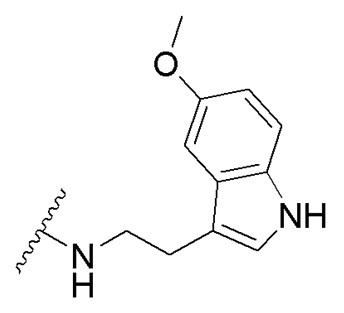
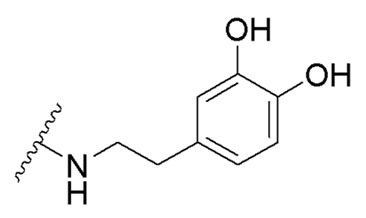
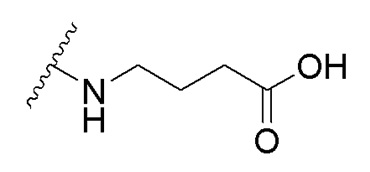
в которой R1 - водород или С1-С6-алкил, R2 - остаток ОТ1 или R3 - остаток ОТ2, R4 - водород или C1-C6-алкил, T1 и T2, которые могут быть одинаковыми или разными, и каждый означает водород, C1- C6-алкил, C1-C6--алконоил, или T1 и T2 совместно с атомами, к которым они присоединены, образуют 5-7-членное гетероциклическое кольцо, которое при желании может быть замещено оксо или тиоксо, или Q - атом кислорода X - атом серы или NH -группу, Y - валентная связь, C1-C6-алкиленовый остаток, который при желании может быть замещен гидроксигруппой или аминогруппой, фениленовый остаток, который при желании может быть одно- или многократно замещен гидроксилом, галогеном, C1-C6-алкилом или карбоксилом, Z - водород, галоген, карбоксил гидроксиметил, C1-C6-алкоксикарбонил, циано или группу NR5R6, причем R5 и R6 совместно с атомом азота, к которому они присоединены, образуют 3-7-членное гетероциклическое кольцо, которое при желании может быть замещено оксо, гидрокси или C1-C6-алкокси, их таутомеры, а также их соли с нетоксическими кислотами или основаниями. Данные представители кумарина из ингибируют pla2 в зависимости от дозы и до 100% и тем самым превосходят известные противовоспалительные соединения (RU2133745, 27.07.1999). , где R1= OH, R2= N-(2-(5-метокси-1Н-индол-3-ил)этил)пропан-2-амин, R3= 4-(2-(изопропиламино)этил)бензол-1,2-диол, R4= 4- (изопропиламино) бутановая кислота, R5= 3-(изопропиламино)пропановая кислота.
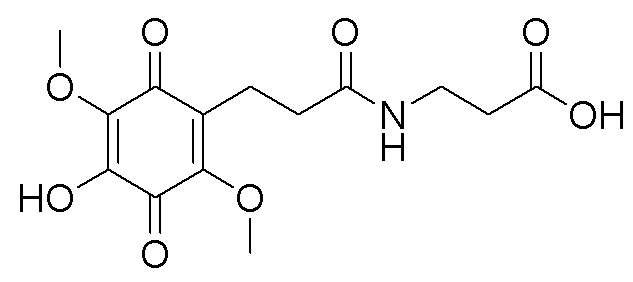
, где R1= OH, R2= N-(2-(5-метокси-1Н-индол-3-ил)этил)пропан-2-амин, R3= 4-(2-(изопропиламино)этил)бензол-1,2-диол, R4= 4- (изопропиламино) бутановая кислота, R5= 3-(изопропиламино)пропановая кислота. получают путем гидролиза соединения формулы В и взаимодействия с кислой средой при комнатной температуре в течение 24 часов в атмосфере воздуха.
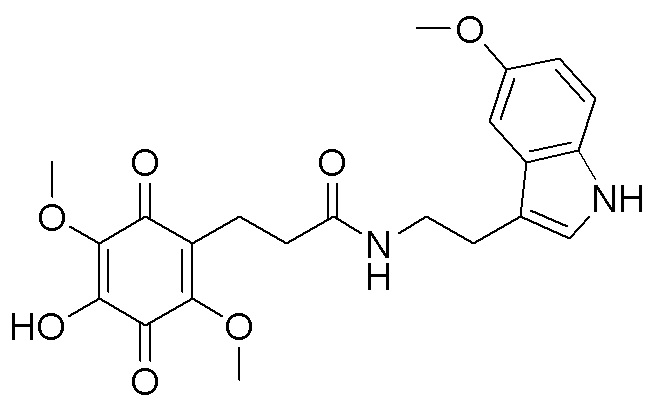
получают путем гидролиза соединения формулы В и взаимодействия с кислой средой при комнатной температуре в течение 24 часов в атмосфере воздуха.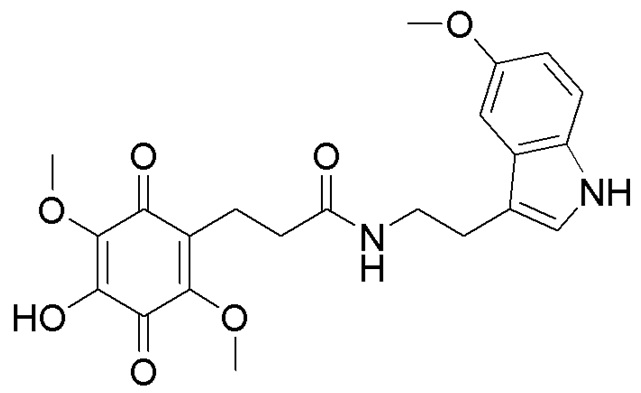 получают путем гидролиза и взаимодействия соединения формулы В с гидрохлоридом 5-метокситриптамином в диоксане при комнатной температуре с использованием кислорода воздуха в качестве окислительного агента.
получают путем гидролиза и взаимодействия соединения формулы В с гидрохлоридом 5-метокситриптамином в диоксане при комнатной температуре с использованием кислорода воздуха в качестве окислительного агента. получают путем гидролиза и взаимодействия соединения формулы В с 3,4-бис(бензилокси)фенетиламином в диоксане при комнатной температуре с использованием кислорода воздуха в качестве окислительного агента, с последующим снятием защитных групп гидрированием на Pd/C, в атмосфере водорода в течение 24 часов и окислением в атмосфере воздуха в течение 24 часов.
получают путем гидролиза и взаимодействия соединения формулы В с 3,4-бис(бензилокси)фенетиламином в диоксане при комнатной температуре с использованием кислорода воздуха в качестве окислительного агента, с последующим снятием защитных групп гидрированием на Pd/C, в атмосфере водорода в течение 24 часов и окислением в атмосфере воздуха в течение 24 часов.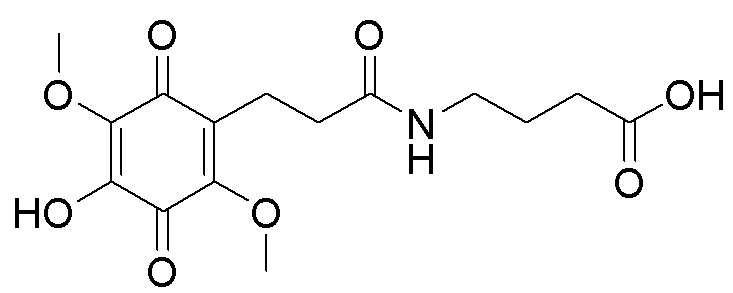 получают путем гидролиза и взаимодействия соединения формулы В с бензиловым эфиром β-аланина в диоксане при комнатной температуре с использованием кислорода воздуха в качестве окислительного агента, с последующим снятием защитных групп гидрированием на Pd/C, в атмосфере водорода в течение 24 часов и окислением в атмосфере воздуха в течение 24 часов.
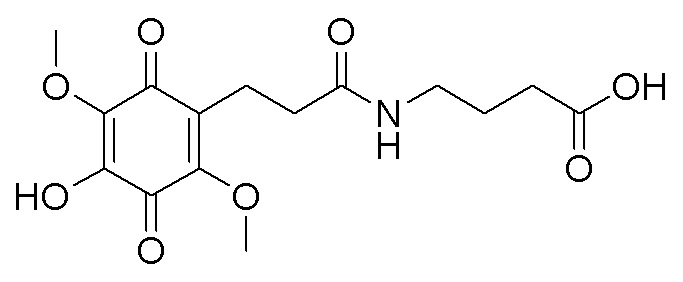
получают путем гидролиза и взаимодействия соединения формулы В с бензиловым эфиром β-аланина в диоксане при комнатной температуре с использованием кислорода воздуха в качестве окислительного агента, с последующим снятием защитных групп гидрированием на Pd/C, в атмосфере водорода в течение 24 часов и окислением в атмосфере воздуха в течение 24 часов. 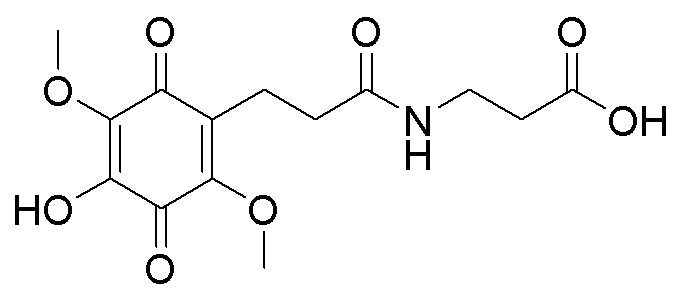 получают путем гидролиза и взаимодействия соединения формулы В с γ-аминомасляной кислотой в диоксане при комнатной температуре с использованием кислорода воздуха в качестве окислительного агента, с последующим снятием защитных групп гидрированием на Pd/C, в атмосфере водорода в течение 24 часов и окислением в атмосфере воздуха в течение 24 часов.
получают путем гидролиза и взаимодействия соединения формулы В с γ-аминомасляной кислотой в диоксане при комнатной температуре с использованием кислорода воздуха в качестве окислительного агента, с последующим снятием защитных групп гидрированием на Pd/C, в атмосфере водорода в течение 24 часов и окислением в атмосфере воздуха в течение 24 часов.