для стартапов
и инвесторов
Предложена рекомбинантная плазмидная ДНК pet302-NT-His-hIFN-λ1 для экспрессии в клетках E. coli рекомбинантного белка интерферона hIFN-λ1, имеющего последовательность SEQ ID NO:3. Также предложен штамм Escherichia coli BL21[DE3]pET302-hIFNL1 – продуцент рекомбинантного белка интерферона hIFN-λ1, имеющий последовательность SEQ ID NO:3. При этом указанный штамм получен путём трансформации клеток штамма E. coli BL21DE3 рекомбинантной плазмидной ДНК pet302-NT-His-hIFN-λ1. Полученный интерферон лямбда является стабильным при хранении и может быть использован в качестве терапевтического средства. 2 н.п. ф-лы, 4 ил., 8 пр. 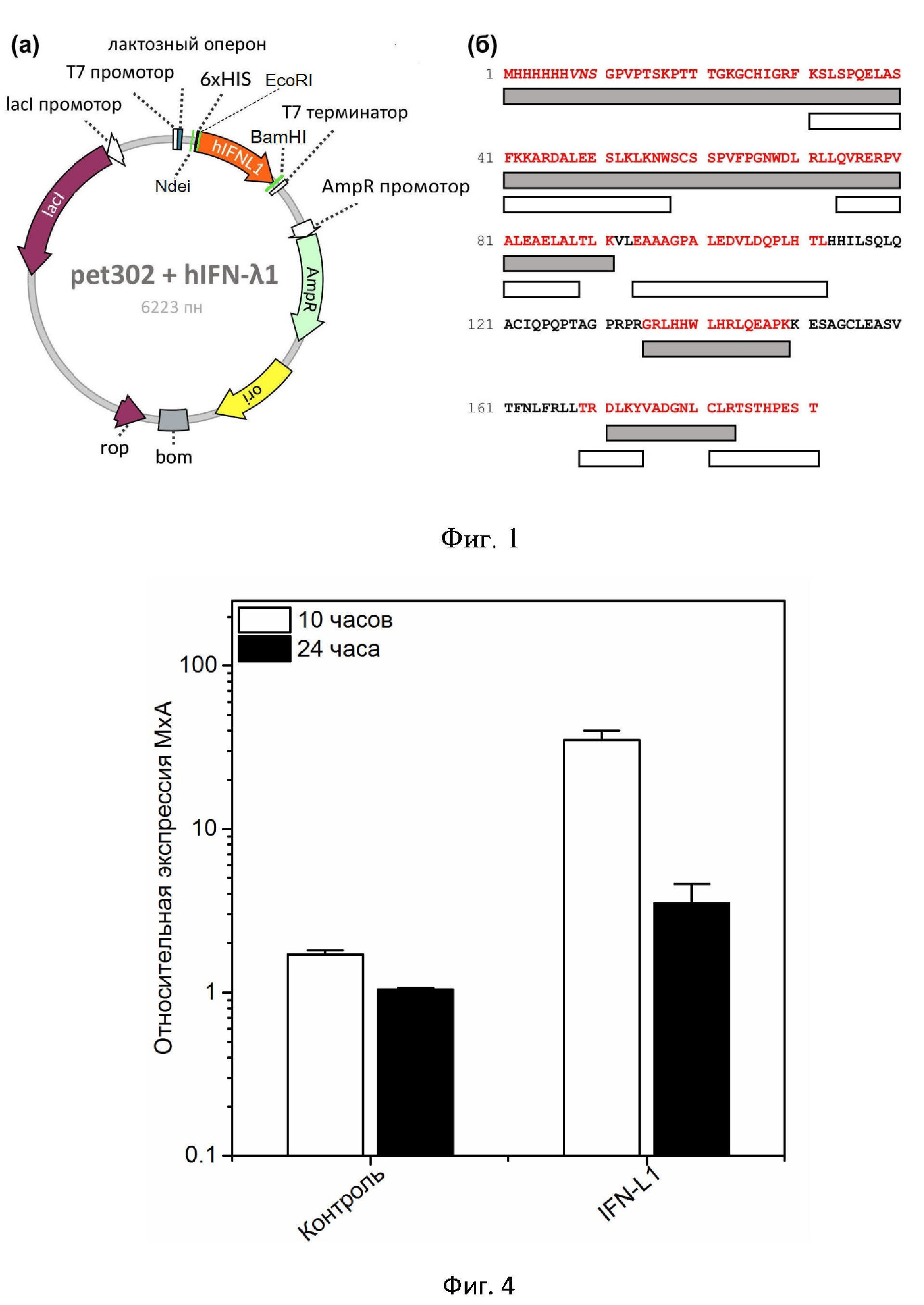
1. Рекомбинантная плазмидная ДНК pet302-NT-His-hIFN-λ1 для экспрессии в клетках E. coli рекомбинантного белка интерферона hIFN-λ1, имеющего последовательность SEQ ID NO:3, имеющая карту плазмиды, как показано на Фиг. 1а, включающая следующие участки:
Область изобретения Изобретение относится к области биотехнологии, а именно к получению штамма-продуцента интерферона лямбда 1 человека (hIFN-λ1) с применением плазмиды pet302/NT-His и клеток E. coli. Предшествующий уровень техники Известен способ получения штамма клеток Е. coli BL21 Star™(DE3) pET302/NT-His tcpA – продуцента рекомбинантного белка ТсрА холерного вибриона биовара Эль Тор (RU2707129, опубл. 22.11.2019), предусматривающий трансформацию клеток штамма Е. coli BL21 Star™(DE3) плазмидой pET302/NT-His, содержащей клонированный фрагмент гена tcpA размером 534 п.н. из плазмиды pCR2.1. tcpA, полученный с помощью ПЦР с использованием олигонуклеотидных праймеров F и R с определенными нуклеотидными последовательностями. Также известен способ получения штамма-продуцента безметионинового рекомбинантного ИЛ-36РА человека (RU2672816, опубл. 19.11.2018), заключающийся в трансформации штамма Escherichia coli BL21Star[DE3] плазмидным экспрессионным вектором pET-IL36Raf и плазмидным экспрессионным вектором pBAD15A или плазмидным экспрессионным вектором рЕТ15А с последующей индукцией экспрессии генов рецепторного антагониста интерлейкина-36 человека (ИЛ-36РА) и метионинаминопептидазы Е. coli. Также известен способ получения безметионинового интерферона альфа-2b человека (RU2697375, опубл. 13.08.2019), включающий в себя культивирование штамма Escherichia coli – продуцента безметионинового интерферона альфа-2b человека, отделение интерферонсодержащей биомассы с последующей хроматографической очисткой целевого продукта, при этом хроматографическую очистку проводят в несколько этапов: - на фенил-сефарозе при pH 5,2 с использованием в качестве растворителя 0,1 М трис-ацетатного буферного раствора, содержащего 0,26 NaCl, 1 мМ этилен-диаминотетрауксусной кислоты (ЭДТА) и 0,1% метионина, - затем хроматографию проводят последовательно на сорбентах Солоза КГ 20/30, Q-сефароза и SP-целлюлоза, при этом интерферон альфа-2b человека сорбируется в 0,25 М трис-ацетатном буферном растворе, содержащем 1 мМ ЭДТА и 0,1% метионина, - на Солозе КГ 20/30 при pH 5,2, элюцию осуществляют 0,05 М трис-буферным раствором с 1 мМ ЭДТА и 0,1% метионина, - на Q-сефарозе при pH 6,5, а элюцию проводят 0,25 М трис-ацетатным буферным раствором, содержащим 1 мМ ЭДТА и 0,1% метионина при pH 5,9, - на SP-целлюлозе при pH 5,2, отмывку проводят 0,05 М натрий-ацетатным буферным раствором, а элюцию проводят 0,05 М натрий-ацетатным буферным раствором с добавлением 0,15 М натрия хлорида. Из вышеприведённых аналогов известно использование плазмиды pet302/NT-His для получения интерферонов. При этом на сегодняшний день не известны способы получения интерферона лямбда 1 человека (hIFN-λ1) с помощью плазмиды pet302/NT-His. Таким образом, ни один из известных способов не может рассматриваться в качестве прототипа заявляемого изобретения. Описание фигур Фиг. 1. (a) Карта рекомбинантной плазмидной ДНК pet302-NT-His-hIFN-λ1. (b) Аминокислотная последовательность рекомбинантного белка 6×His-hIFN-λ1. Дополнительные аминокислотные остатки между полигистидиновой меткой и hIFN-λ1 выделены курсивом. Отмечены фрагменты последовательности, идентифицированные с помощью метода масс-спектрометрии: серые и белые полосы указывают на ферментативное расщепление трипсином и химотрипсином, соответственно. Фиг. 2. Электрофореграмма фракций лизатов штамма-продуцента hIFN-λ1 (E. coli BL-21). Продукция рекомбинантного белка. «Overnight culture» – ночная культура, полученная для продукции, «Before induction» – клеточный лизат до добавления индуктора, «After induction» – клеточный лизат через 3 ч после добавления индуктора, NC – отрицательный контроль (E. coli BL-21 без плазмиды). Фиг. 3. Сравнение результатов ИФА hIFN-λ1 при разных условиях хранения (при температуре +4°C и –80°C). В дополнение, представлены результаты, полученные для коммерческого стандарта из набора Human IL-29/IL-28B (IFN-lambda 1/3) DuoSet ELISA (#DY1598B, R&D Systems, Германия). Фиг. 4. Изменение экспрессии MxA в клетках A549, обработанных hIFN-λ1 (10 нг/мл) в течение 10 и 24 ч инкубации. По оси ординат отложены значения относительной экспрессии MxA, по оси абсцисс – условия обработки клеток. Описание изобретения Предложена рекомбинантная плазмидная ДНК pet302/NT-His + hIFNL1 для экспрессии в клетках E. coli рекомбинантного белка человеческого интерферона лямбда (hIFN-λ1), имеющая карту плазмиды, как показано на Фиг. 1a, включающая следующие участки: - ген β-лактамазы (AmpR), определяющий устойчивость бактериальных клеток к ампициллину; - участок инициации репликации (ori); - ROP ген, регулирующий копийность плазмиды; - фрагмент, содержащий T7 терминатор транскрипции; - транскрипционный репрессор LacI, регулирующий транскрипцию T7lac-промотора; - EcoRI/BamHl фрагмент, содержащий искусственный ген hIFN-λ1; - Ndel/BamHl фрагмент, кодирующий рекомбинантный белок hIFN-λ1, в котором нуклеотидная последовательность соответствует SEQ ID NO:1; - уникальные сайты узнавания рестрикционными эндонуклеазами со следующими координатами: BglII – 0, Xba – 66, NdeI – 107, EcoRI – 132, BamHI – 685. Кроме того, согласно изобретению, предложен штамм Escherichia coli BL21[DE3]pET302-hIFNL1 – продуцент рекомбинантного белка с последовательностью интерферона лямбда 1 человека (hIFN-λ1), при этом штамм получен путём трансформации клеток штамма E. coli BL21 рекомбинантной плазмидной ДНК pet302/NT-His + hIFNL1, имеющей карту, показанную на Фиг. 1a. Техническая проблема заключается в необходимости разработки эффективного способа получения штамма-продуцента рекомбинантного белка hIFN-λ1 с применением рекомбинантной плазмидной ДНК pet302/NT-His и доступных клеток-продуцентов, например, E. coli. Технический результат состоит в получении штамма-продуцента Escherichia coli BL21[DE3]pET302-hIFNL1, который является продуцентом рекомбинантного белка hIFN-λ1. Технический результат достигается за счёт того, что путём трансформации клеток Escherichia coli рекомбинантной плазмидной ДНК pet302/NT-His + hIFNL1 получен штамм E. coli BL21[DE3]pET302, который является продуцентом рекомбинантного белка hIFN-λ1. Данный штамм был депонирован в Биоресурсный Центр Всероссийской Коллекции Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» – ГосНИИгенетика под № В-13870. Также технический результат достигается за счёт того, что для трансформации клеток E. coli для получения рекомбинантного белка интерферона hIFN-λ1 синтезируют и кодируют в рекомбинантную плазмидную ДНК pet302/NT-His, оптимизированную in silico, последовательность SEQ ID NO:1, кодирующую рекомбинантный белок интерферон лямбда 1 человека (hIFN-λ1) с последовательностью SEQ ID NO:3, причём рекомбинантная плазмидная ДНК содержит последовательность, кодирующую полигистидиновую метку на N-конце синтезируемого белка. Далее получают ДНК-конструкцию pet302-NT-His-hIFN-λ1, с помощью которой трансформируют культуру клеток E. coli с последующим получением штамма-продуцента E. coli BL21[DE3]pET302-hIFNL1. Получаемый рекомбинантный белок человеческого интерферона лямбда 1 обладает стабильностью при хранении и может быть использован в терапевтических целях, например, в качестве противоопухолевых, противовирусных, противогрибковых препаратов, а также как препарат с иммуномодулирующей активностью. Человеческий интерферон лямбда можно применять при лечении синдрома Шегрена, атопической астмы, аутоиммунного артрита, а также в отношении самых разных, как РНК-, так и ДНК-содержащих вирусов, которые атакуют поверхности анатомических барьеров дыхательных путей, желудочно-кишечного тракта, гематоэнцефалического барьера и печени. Далее способ получения рекомбинантной плазмидной ДНК и рекомбинантного белка человеческого интерферона лямбда будет описан в виде примеров, которые предназначены для иллюстрации изобретения и никоим образом не ограничивают его. Примеры Пример 1 Получение рекомбинантной плазмидной ДНК pet302-NT-His-hIFN-λ1 Оптимизированная in silico (http://genomes.urv.es/OPTIMIZER/obtimized.php) последовательность, кодирующая рекомбинантный белок интерферона hIFN-λ1, была синтезирована и клонирована в рекомбинантную плазмидную ДНК pet302/NT-His компанией «Евроген». Последовательность была проверена секвенированием и не имела ошибок. В частности, рекомбинантная плазмидная ДНК pet302/NT-His содержала последовательность, кодирующую гистидиновую метку перед клонируемым геном (5’-конец ДНК, N-конец белка), таким образом, транслировала гибридный белок интерферона hIFN-λ1 с шестью гистидинами на N-конце. Полученная конструкция рекомбинантной плазмидной ДНК представлена на Фиг. 1a. Конечная аминокислотная последовательность рекомбинантного белка, кодируемого рекомбинантной плазмидной ДНК pet302-NT-His-IFN-λ1 (6×His-hIFN-λ1), представлена в SEQ ID NO:3. Пример 2 Получение рекомбинантного белка hIFN-λ1 При индукции IPTG культуры клеток E. coli BL-21 DE3, трансформированной рекомбинантной плазмидной ДНК pet302-NT-His-hIFN-λ1, была показана экспрессия интерферона лямбда 1 с молекулярной массой около 21 кДа. Теоретическая молекулярная масса белка составила 21,3 кДа. Время инкубации с индуктором составило 3 часа. Каждый образец подвергался фракционированию. Целевой белок экспрессировался в форме телец включения, для его выделения в дальнейшем клетки разрушали и фракционировали стандартными методами. Наработку рекомбинантного белка hIFN-λ1 вели на клетках E. coli, трансформированных рекомбинантной плазмидной ДНК pet302-NT-His- hIFN-λ1, в среде LB с содержанием ампициллина 100 мкг/мл при температуре 37°C и скорости вращения платформы 250 об/мин. При достижении оптической плотности (OD600) культуры 0,7 о.е. добавляли индуктор (IPTG) до необходимой концентрации. Культивирование проводили в условиях индукции в течение дополнительных 3 ч. Электрофореграмма лизатов штамма-продуцента рекомбинантного белка hIFN-λ1 E. coli BL-21 + pet302-NT-His-hIFN-λ1 представлена на Фиг. 2. Отрицательный контроль (NC) – E. coli BL-21 без рекомбинантной плазмидной ДНК, overnight culture – ночная культура, пересеянная для наработки, before induction – лизат клеток перед добавлением индуктора, after induction – лизат клеток через 3 часа после добавления индуктора. Пример 3 Получение штамма-продуцента рекомбинантного белка hIFN-λ1 Использовали следующие материалы и методы. В работе использовали реагенты производства Sigma-Aldrich (Трис, Na2HPO4, NaCl, ЭДТА, PMSF, Tween 20, глицерин, ацетонитрил, TFA, трегалозу, L-аргинин, ацетат натрия, уксусную кислоту, соляную кислоту и мочевину). В процессе хроматографической очистки использовали колонки HisTrap FF Crude 1 мл и Source 15S 4.6/100 производства GE Healthcare (США), а также обессаливающий картридж BioScale Mini P6 10 мл производства Bio-Rad (США). Для электрофоретического анализа использовали предзалитые гели TGX anyKD SDS-PAGE производства Bio-Rad. Уровень эндотоксина был определён при помощи коммерческого набора LAL Chromogenic Endpoint Assay (#HIT302, Hycult Biotech). Для ферментативного гидролиза использовали трипсин и химотрипсин (Promega, США). Матрицы для масс-спектрометрии MALDI-TOF (HCCA) были изготовлены компанией Bruker (Германия). Уровень интерферона лямбда 1 человека оценивали с использованием набора Human IL-29/IL-28B (IFN-lambda 1/3) DuoSet ELISA (DY1598B, R&D Systems, Германия). Тотальную РНК выделяли с помощью реагента TRIzol (Invitrogen, США) согласно инструкции производителя. После выделения РНК образцы подвергали обратной транскрипции с использованием M-MLV обратной транскриптазы (Promega, США). ПЦР в режиме реального времени проводили с использованием амплификатора CFX96 Touch производства Bio-Rad. Реакционная смесь содержала: 12,5 мкл 2-кратной смеси BioMaster HS-qPCR (Биолабмикс, Россия), 2 мкл однонитевой кДНК, по 0,6 мкМ прямого и обратного праймера и флуоресцентного зонда. Амплификацию выполняли при следующих условиях: начальная денатурация 95°C 5 мин, затем 40 циклов: 95°C 15 с, 60°C 60 с, детекция флуоресценции. Для каждой экспериментальной точки использовали не менее трёх биологических повторов. Пример 4 Создание рекомбинантной плазмидной ДНК с участком для экспрессии рекомбинантного белка hIFN-λ1 Оптимизированная in silico (https://www.genscript.com/tools/gensmart-codon-optimization) последовательность, кодирующая интерферон лямбда 1 человека (hIFN-λ1) с последовательностью SEQ ID NO:2, была синтезирована компанией «Евроген» и клонирована в рекомбинантную плазмидную ДНК pet302/NT-His. Рекомбинантная плазмидная ДНК pet302-NT-His-hIFN-λ1 содержит последовательность, кодирующую полигистидиновую метку на N-конце синтезируемого белка, SEQ ID NO:3. Полученная конструкция рекомбинантной плазмидной ДНК pet302-NT-His-hIFN-λ1 была проверена на наличие ошибок секвенированием. Пример 5 Экспрессия рекомбинантного белка hIFN-λ1 Культуры клеток E. coli (штамм BL-21 DE3) трансформировали рекомбинантной плазмидной ДНК pet302-NT-His-hIFN-λ1 и высеивали на чашках со средой LB с ампициллином 100 мкг/мл. Отдельные колонии переносили с чашек в среду LB и культивировали всю ночь. Далее проводили инокуляцию полученными культурами свежей среды LB (до OD600 = 0,1), содержащей ампициллин. Бактериальные культуры культивировали на орбитальном шейкере до значения OD600 равного 0,7. Для культивирования синтез белка индуцировали индуктором IPTG до необходимых концентраций, культуры инкубировали на орбитальном шейкере в течение Пример 6 Очистка и рефолдинг рекомбинантного белка интерферона hIFN-λ1 Хроматографическую очистку проводили на аппарате AKTA pure производства GE Healthcare. Первичную очистку рекомбинантного белка интерферона hIFN-λ1 проводили методом металл-аффинной хроматографии в денатурирующих условиях. Клетки штамма-продуцента осаждали центрифугированием, и далее, влажный осадок ресуспендировали в денатурирующем буфере (20 мМ фосфат натрия, 300 мМ хлорид натрия, 8 М мочевина, 20 мМ имидазол, pH 7,8, 1 мМ PMSF) и обрабатывали суспензию ультразвуком на ледяной бане. Далее, полученный лизат осветляли центрифугированием в течение 20 мин при +10°С с ускорением 13000 g. Хроматографическую колонку HisTrap FF Crude объёмом 1 мл уравновешивали стартовым буфером (30 мМ фосфат натрия, 300 мМ хлорид натрия, 8 М мочевина, 20 мМ имидазол, pH 7,8) на скорости потока Рефолдинг рекомбинантного белка hIFN-λ1 проводили методом разбавления. Охлаждённый раствор для рефолдинга помещали на магнитную мешалку, после чего добавляли по каплям раствор денатурированного рекомбинантного белка интерферона hIFN-λ1 (2 мг/мл) в соотношении 1:10. Полученный раствор перемешивали в течение 10 минут, после чего инкубировали в течение 24 часов при +4°С. Полученный раствор рефолдированного рекомбинантного белка интерферона hIFN-λ1 фильтровали через тупиковый фильтр. Финальную очистку проводили методом катионообменной хроматографии. Хроматографическую колонку Source 15S 4.6/100 уравновешивали 8 мл стартового буфера (20 мМ трис-гидрохлорид, 2 мМ ЭДТА, pH 7,5) на скорости потока 2 мл/мин. Далее, вносили раствор рекомбинантного белка интерферона hIFN-λ1 и отмывали колонку 10 мл стартового буфера на скорости потока 2 мл/мин. Целевой белок элюировали линейным градиентом от 0 до 1 М хлорида натрия в стартовом буфере на скорости потока 2 мл/мин в течение 15 мин. Мониторинг элюата осуществляли по оптической плотности на длине волны 280 нм, отбирали фракции объемом 0,5 мл, имеющие значение OD280 больше 25 мЕд оптической плотности. Фракции анализировали методом электрофореза в полиакриламидном геле. Фракции, содержащие целевой белок с минимумом примесей, объединяли и переводили в фосфатно-солевой буфер, pH 7,2, при помощи обессаливающего картриджа Bio-Scale Mini P6 Desalting (Bio-Rad). Концентрацию рекомбинантного белка интерферона hIFN-λ1 определяли методом Лоури. Она составляла 3,6 мг/мл. Пример 7 Анализ полученного рекомбинантного интерферона hIFN-λ1 ПААГ-электрофорез Анализ чистоты полученного рекомбинантного белка hIFN-λ1 проводили методом ПААГ-электрофореза по методу Лэммли в восстанавливающих условиях [Laemmli, 1970]. Для этого использовали предзалитые гели TGX anyKD, источник постоянного тока PowerPac Basic и камеру для ПААГ-электрофореза Mini Protean Tetra производства Bio-Rad. Гель окрашивали раствором красителя Кумасси как описано в [Shaldzhyan et al., 2020], после чего отмывали и визуализировали при помощи системы гель-документации ChemiDoc MP и анализировали при помощи программного обеспечения Image Lab Software производства Bio-Rad. ELISA Уровень рекомбинантного белка hIFN-λ1 оценивали с помощью набора ELISA DuoSet Human IL-29/IL-28B (IFN-lambda 1/3) (DY1598B, R&D Systems, Германия) в соответствии с инструкцией производителя. Коммерческий набор Mouse IL-28 A/B (IFN-lambda 2/3) DuoSet ELISA (DY1789B, R&D Systems, Германия) использовали для оценки перекрёстной реактивности. MALDI-TOF Аминокислотная последовательность рекомбинантного белка интерферона hIFN-λ1 SEQ ID NO:3 была подтверждена с помощью MALDI-TOF. Фрагменты геля вырезали и дважды отмывали от красителя, используя раствор, содержащий 30 мМ NH4HCO3 и 40% ацетонитрила. После этого кусок геля обезвоживали 100% ацетонитрилом, сушили на воздухе и подвергали ферментативному расщеплению трипсином или химотрипсином. К гелю добавляли трипсин (20 мкг/мл в 50 мМ NH4HCO3) и проводили инкубацию в течение 2 ч в при 60°С. Инкубацию с химотрипсином (20 мкг/мл в 100 мМ Трис-HCl, 1 мМ CaCl2, pH 8,0) проводили в течение 18 ч при 25°C. В обоих случаях реакцию останавливали 1% ТФУ, 10% ацетонитрила. Пептиды после ферментативного расщепления смешивали с матрицей HCCA, наносили на металлическую мишень и масс-спектры записывали в отражательном режиме регистрации положительных ионов с использованием масс-спектрометра MALDI-TOF UltrafleXtreme (Bruker). Спектры обрабатывали в программе flexAnalysis (Bruker). Идентификацию белков проводили в BioTools (Bruker) с использованием MASCOT (http://www.matrixscience.com/). Следует отметить, что аминокислотная последовательность рекомбинантного белка SEQ ID NO:3 была добавлена в локальную базу данных, и в процессе идентификации одновременно использовались две базы данных (локальная и SwissProt, https://www.uniprot.org/). Допуск по массе был установлен как 20 частей на миллион, окисление метионина обозначено как изменяемая модификация. Идентификация считалась достоверной в случае, если Score спектров превышал пороговое значение (p <0,05). Результаты представлены на Фиг. 1б. Пример 8 Проверка биологической активности hIFN-λ1 Как известно, интерфероны I и III типов, действуя через свои гетеродимерные рецепторы, индуцируют экспрессию ISGs (Interferon Stimulated Genes). Одним из ключевых антивирусных ISG является MxA [Randall, 2008]. В отличие от большинства ISGs гены Mx не характеризуются конститутивной экспрессией, но их экспрессию специфически вызывает действие интерферонов типов I и III, что позволяет считать MxA превосходным маркером активации интерферон-зависимого ответа [Haller, 2015]. Следовательно, действие биологически активного интерферона Обработка клеток В работе использовали клетки линии А549 (линия клеток карциномного альвеолярного базального эпителия; #CCL-185, ATCC, США). Клетки A549 культивировали в F12K c 1% GlutaMax с 10% фетальной бычьей сывороткой и высевали на 12-луночные планшеты по 5×105 клеток на лунку. Монослой клеток промывали DPBS и инкубировали с рекомбинантным белком hIFN-λ1 (10 нг/мл). После 10 или 24 ч инкубации при 37°C в увлажнённом воздухе с 5% CO2 рекомбинантный белок hIFN-λ1 удаляли. Монослой клеток снова промывали DPBS. Были собраны обработанные клеточные культуры и необработанные контрольные образцы. Выделение РНК Тотальную РНК выделяли из клеток A549 с использованием реагента TRIzol (Invitrogen, США) в соответствии с инструкцией производителя. Концентрацию и целостность РНК измеряли на спектрофотометре NanoDrop ND-1000 (NanoDrop Technologies, США). Реакция обратной транскрипции После выделения РНК образцы подвергали обратной транскрипции с использованием обратной транскриптазы M-MLV RT (Promega, США). Смесь 2 мкг общей РНК и 1 мкг праймеров олиго-(dT)16 («ДНК-Синтез», Россия), доведённых MQ-водой до конечного объёма 12 мкл, инкубировали при 70°C в течение 5 мин. Пробирки немедленно охлаждали на льду, а затем добавляли смесь (5 мкл 5-кратного реакционного буфера MMLV (Promega), 1,5 мкл 5 мМ dNTP (Promega), 1 мкл M-MLV RT (Promega), 5,5 мкл MQ-воды). Синтез кДНК проводили при 42°C в течение 60 мин. Затем M-MLV RT инактивировали нагреванием (65°C, 5 мин). кДНК хранили при –20°С. ПЦР в режиме реального времени ПЦР в режиме реального времени выполняли с использованием амплификатора CFX96 Touch (Bio-Rad). Реакционная смесь для ПЦР содержала 12,5 мкл BioMaster HS-qPCR (2×) (Биолабмикс, Россия), 0,5 мкл (0,6 мкМ) каждого праймера и зонд, 2 мкл однонитевой кДНК и 9 мкл MQ-воды. Амплификацию проводили при следующих условиях: начальная денатурация при 95°C в течение 5 мин; 40 циклов 95°C в течение 15 с, 60°C в течение 60 с, детекция флуоресценции. Метод порогового значения сравнительного цикла (ΔΔCt) использовали для количественного определения экспрессии MxA, результаты были нормализованы к уровню экспрессии эндогенного контроля GAPDH. В каждом эксперименте использовали не менее трёх биологических повторов. Результаты представлены на Фиг. 4. ---> ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ <110> федеральное государственное автономное образовательное учреждение высшего образования «Санкт-Петербургский политехнический университет Петра Великого» <120> Штамм бактерий Escherichia Coli – продуцент рекомбинантного белка IL-29 <160> 3 <170> PatentIn version 3.5 <210> 1 <211> 576 <212> DNA <213> Escherichia coli <400> 1 atgcatcatc atcatcatca cgtgaattcc ggtccggttc cgacctccaa accgaccacc 60 accggtaaag gttgccacat cggtcgtttc aaatctctgt ctccgcagga actggcgtct 120 ttcaaaaaag cgcgtgacgc actggaagaa tctctgaaac tgaaaaactg gtcttgctct 180 tctccggttt tcccgggtaa ctgggacctg cgtctgctgc aggttcgtga acgtccggtt 240 gcgctggaag cggaactggc gctgaccctg aaagttctgg aagcggcagc gggtccggcg 300 ctggaagacg ttctggacca gccgctgcac accctgcacc acatcctgtc tcagctgcag 360 gcgtgcatcc agccgcaacc gaccgcaggt ccgcgtccgc gtggtcgtct gcaccactgg 420 ctgcaccgtc tgcaggaagc gccgaagaaa gaatctgcgg gttgcctgga agcgtctgtt 480 accttcaacc tgttccgtct gctgacccgt gacctgaaat acgttgcgga cggtaacctg 540 tgcctgcgta cctctaccca cccggaatct acctga 576 <210> 2 <211> 182 <212> PRT <213> Escherichia coli <400> 2 Met Gly Pro Val Pro Thr Ser Lys Pro Thr Thr Thr Gly Lys Gly Cys 1 5 10 15 His Ile Gly Arg Phe Lys Ser Leu Ser Pro Gln Glu Leu Ala Ser Phe 20 25 30 Lys Lys Ala Arg Asp Ala Leu Glu Glu Ser Leu Lys Leu Lys Asn Trp 35 40 45 Ser Cys Ser Ser Pro Val Phe Pro Gly Asn Trp Asp Leu Arg Leu Leu 50 55 60 Gln Val Arg Glu Arg Pro Val Ala Leu Glu Ala Glu Leu Ala Leu Thr 65 70 75 80 Leu Lys Val Leu Glu Ala Ala Ala Gly Pro Ala Leu Glu Asp Val Leu 85 90 95 Asp Gln Pro Leu His Thr Leu His His Ile Leu Ser Gln Leu Gln Ala 100 105 110 Cys Ile Gln Pro Gln Pro Thr Ala Gly Pro Arg Pro Arg Gly Arg Leu 115 120 125 His His Trp Leu His Arg Leu Gln Glu Ala Pro Lys Lys Glu Ser Ala 130 135 140 Gly Cys Leu Glu Ala Ser Val Thr Phe Asn Leu Phe Arg Leu Leu Thr 145 150 155 160 Arg Asp Leu Lys Tyr Val Ala Asp Gly Asn Leu Cys Leu Arg Thr Ser 165 170 175 Thr His Pro Glu Ser Thr 180 <210> 3 <211> 191 <212> PRT <213> Escherichia coli <400> 3 Met His His His His His His Val Asn Ser Gly Pro Val Pro Thr Ser 1 5 10 15 Lys Pro Thr Thr Thr Gly Lys Gly Cys His Ile Gly Arg Phe Lys Ser 20 25 30 Leu Ser Pro Gln Glu Leu Ala Ser Phe Lys Lys Ala Arg Asp Ala Leu 35 40 45 Glu Glu Ser Leu Lys Leu Lys Asn Trp Ser Cys Ser Ser Pro Val Phe 50 55 60 Pro Gly Asn Trp Asp Leu Arg Leu Leu Gln Val Arg Glu Arg Pro Val 65 70 75 80 Ala Leu Glu Ala Glu Leu Ala Leu Thr Leu Lys Val Leu Glu Ala Ala 85 90 95 Ala Gly Pro Ala Leu Glu Asp Val Leu Asp Gln Pro Leu His Thr Leu 100 105 110 His His Ile Leu Ser Gln Leu Gln Ala Cys Ile Gln Pro Gln Pro Thr 115 120 125 Ala Gly Pro Arg Pro Arg Gly Arg Leu His His Trp Leu His Arg Leu 130 135 140 Gln Glu Ala Pro Lys Lys Glu Ser Ala Gly Cys Leu Glu Ala Ser Val 145 150 155 160 Thr Phe Asn Leu Phe Arg Leu Leu Thr Arg Asp Leu Lys Tyr Val Ala 165 170 175 Asp Gly Asn Leu Cys Leu Arg Thr Ser Thr His Pro Glu Ser Thr 180 185 190 <---
3 ч. Далее клетки разрушали, обрабатывая культуральную среду ультразвуком на ледяной бане (10 импульсов по 10 секунд с интервалами в 30 секунд). Полученные лизаты центрифугировали в течение 1 ч при +4°C с ускорением 20000 g и отделяли супернатанты от осадков, содержащих в том числе белки в нерастворимой форме. Уровень экспрессии рекомбинантного белка hIFN-λ1 и его наличие в растворимой форме или в форме нерастворимых телец включения определяли методом электрофореза в полиакриламидном геле (ПААГ-электрофорез). Результаты представлены на Фиг. 2.
0,5 мл/мин. Далее, осветлённый лизат вносили в колонку на скорости потока 0,2 мл/мин, после чего колонку отмывали 20 мл стартового буфера. Целевой белок элюировали 5 мл элюирующего буфера (30 мМ фосфат натрия, 300 мМ хлорид натрия, 8 М мочевина, 500 мМ имидазол, pH 7,8) на скорости потока 0,2 мл/мин. Мониторинг элюата осуществляли по оптической плотности на длине волны 280 нм, отбирали фракцию целевого белка, имеющую значение OD280 больше 300 мЕд оптической плотности. К фракции целевого белка добавляли ЭДТА до конечной концентрации 5 мМ. Концентрацию белка определяли методом интегрирования хроматограммы при помощи программного обеспечения Unicorn 6, полагая значения поглощения 0,1% раствора на длине волны 280 нм для рекомбинантного белка hIFN-λ1, равным 0,85 на 1 см оптического пути (рассчитано на основании первичной последовательности белка при помощи сервиса ProtParam).
hIFN-λ1 должно приводить к индукции экспрессии MxA. Для определения изменений уровня мРНК MxA было произведено выделение РНК, обратная транскрипция и поставлен анализ методом ПЦР в режиме реального времени.

